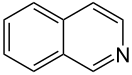
Изохинолин
| Изохинолин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | бензо[c]пиридин | ||
| Хим. формула | C9H7N | ||
| Физические свойства | |||
| Молярная масса | 129,16 г/моль | ||
| Энергия ионизации | 8,53 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 25,5 °C | ||
| • кипения | 243,25 °C | ||
| Тройная точка | K ( °C), Па | ||
| Критическая точка | K ( °C), Па | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 5,40 | ||
| Структура | |||
| Дипольный момент | 9,1E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 119-65-3 | ||
| PubChem | 8405 | ||
| Рег. номер EINECS | 204-341-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16092 | ||
| ChemSpider | 8098 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Изохинолин — гетероциклическое органическое соединение состава C9H7N.
Свойства
Физические свойства
Бесцветные кристаллы со слабым запахом миндаля;Тпл=24,5 °C, Ткип=243 °C. Изохинолин плохо растворим в холодной воде, в органических растворителях — хорошо.
Обнаружение изохинолина в природе
Он содержится в небольшом количестве в каменноугольном дёгте, откуда его выделяют вместе с хинолином.
Основность
Изохинолин — более сильное основание, чем хинолин.
Образование четвертичных солей
При протонировании изохинолин образует соли изохинолиния; с алкил-, ацил-, арилгалогенидами и диметилсульфатом образует четвертичные соли.
Гидрирование изохинолина
При гидрировании над платиной превращается в 1,2,3,4-тетрагидроизохинолин; при полном гидрировании — в цис-декагидроизохинолин.
Окисление смесью озона и кислорода приводит к пиридин-3,4-дикарбоновой кислоте (цинхомероновая кислота), окисление пероксокислотами ведёт к изохинолин-N-оксиду.
Реакции
Реакция электрофильного замещения
Реакции электрофильного замещения происходят в положении 5. Бромирование легче протекает в присутствии AlCl3, нитрование идёт при действии серной и азотной кислот. Сульфирование при действии 40%-ного олеума при температуре 180оС приводит обычно к изохинолин-8-сульфокислоте. Сульфирование 60%-ной серной кислотой при 300оС ведёт к смеси изохинолин-5- и изохинолин-8-сульфокислот.
При высокой температуре изохинолин вступает в реакции бромирования по радикальному механизму с образованием 1-бромизохинолина.
Реакция нуклеофильного замещения
Нуклеофильное замещение протекает как правило в положение 1. С гидроксидом калия при 200оС изохинолин образует 1-гидроксиизохинолин, с амидом натрия — 1-аминоизохинолин.
Изохинолин — токсичное вещество. В соответствии с ГОСТ 12.1.007.76 изохинолин является токсичным высокоопасным веществом по степени воздействия на организм, 2-го класса опасности[2][3]. При вдыхании вызывает функциональные расстройства ЦНС. Раздражает слизистые оболочки глаз и кожи в высокой концентрации.
Рекомендуемая ПДК изохинолина в воздухе рабочей зоны составляет 0,5 мг/м³[4], ЛД50 на крысах — 34 — 140 мг/кг[5].
Изохинолин является горючим веществом. Многие реакции с органикой могут приводить к взрыву.
Получение
Важнейший метод получения изохинолина и его производных — циклодегидратация β-фенилэтиламидов кислот C6H5CH2CH2NHCOR (реакция Бишлера — Напиральского) с последующим дегидрированием образующихся 3,4-дигидроизохинолинов.
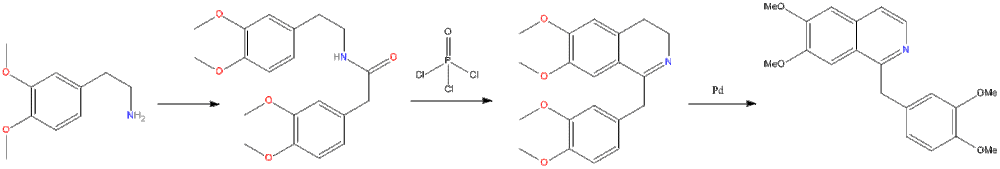
Другие методы синтеза изохинолина и его производных: метод Померанца — Фрича (конденсация ацетофенона с а-аминоацетацеталем); метод Пикте — Шпенглера.
Применение
Изохинолин служит исходным продуктом при синтезе сенсибилизирующих красителей (например, изохинолинового красного) и лекарственных средств.
Изохинолиновое ядро входит в структуру ряда важных алкалоидов (папаверина, морфина, кодеина, курарина и др.).
Примечания
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ name=https://docs.cntd.ru_Isoquinoline
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007.76. ССБТ. Вредные вещества. Классификация и общие требования безопасности
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005.88. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- ↑ name=docs.cntd.ru_ЛД50
Литература
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.