Протео́мика — область молекулярной биологии, посвящённая идентификации и количественному анализу белков. Термин «протеомика» был предложен в 1997 году. Совокупность всех белков клетки называют протеомом.
Протеом — совокупность белков организма, производимых клеткой, тканью или организмом в определённый период времени. Или, более строго, это совокупность экспрессированных белков в данном типе клеток или в организме, в данный период времени при данных условиях. Термин является производным слова «протеин» (белок), аналогичным по происхождению слову «геном».

Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.
Секвени́рование биополимеров — определение их аминокислотной или нуклеотидной последовательности. В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 пар нуклеотидов и 1000 пар нуклеотидов при секвенировании по Сенгеру. В результате секвенирования перекрывающихся участков ДНК получают последовательности участков генов, целых генов, тотальной мРНК или полных геномов организмов.

Электрофоре́з — это электрокинетическое явление перемещения частиц дисперсной фазы в жидкой или газообразной среде под действием внешнего электрического поля. Впервые было открыто профессорами Московского университета П. И. Страховым и Ф. Ф. Рейссом в 1809 году.

Арне Тиселиус — шведский биохимик, член Шведской АН и её президент с 1956 года. Лауреат Нобелевской премии (1948).

Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда. Амфотерные молекулы (цвиттер-ионы) содержат как положительные, так и отрицательные заряды, наличием которых определяется pH раствора. Заряд различных функциональных групп таких молекул может меняться в результате связывания или, наоборот, потери протонов H+. Значение изоэлектрической точки такой амфотерной молекулы определяется величинами констант диссоциации кислотной и основной фракций:


Полиакриламид — общее название группы полимеров и сополимеров на основе акриламида и его производных.

Электрофоре́з белко́в — способ разделения смеси белков на фракции или индивидуальные белки, основанный на движении заряженных белковых макромолекул различного молекулярного веса в стационарном электрическом поле. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка. Наиболее распространенным вариантом электрофоретического анализа белков является электрофорез белков в полиакриламидном геле по Лэммли.
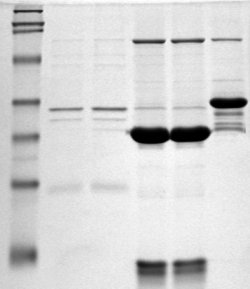
Электрофорез белков в полиакриламидном геле — метод разделения смесей белков в полиакриламидном геле в соответствии с их электрофоретической подвижностью. Данный способ фракционирования белков и пептидов широко применяют в современной молекулярной биологии, биохимии, генетике.
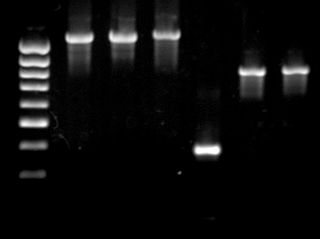
Электрофорез ДНК в агарозном геле — аналитический метод, применяемый для разделения фрагментов ДНК по длине. Основан на разной скорости движения фрагментов разной длины при движении в геле под действием внешнего электрического поля.
Электрофорез в полиакриламидном геле — метод молекулярной биологии и биохимии, используемый для разделения белков и нуклеиновых кислот, основанный на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также от конфигурации молекул. Различают т. н. неденатурирующий, или нативный ПААГ-электрофорез и денатурирующий ПААГ-электрофорез. В процессе денатурирующего ПААГ-электрофореза молекулы сохраняются в денатурированном состоянии за счёт наличия в геле хаотропных агентов в случае ПААГ-электрофореза нуклеиновых кислот и белков и наличия ионных и неионных детергентов.
- В случае электрофореза белков в полиакриламидном геле метод обычно используют в модификации Леммли (Laemmli)
- Также электрофорез в полиакриламидном геле применяют для разделения коротких фрагментов нуклеиновых кислот, например, ДНК-электрофорез, например, при секвенировании по Сэнгеру. Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ и ПЦР.
- Различают также т. н. диск-электрофорез, при котором в геле в процессе электрофоретического разделения белков на границе между концентрирующим и разделяющим гелями создаётся градиент pH, за счёт чего достигается лучшее разделение белковых молекул.

Ге́рман Васи́льевич Тро́ицкий — советский биохимик, доктор биологических наук, кандидат медицинских наук, профессор, заслуженный деятель науки Украины, лауреат премии имени А. В. Палладина АН Украины, член-корреспондент Академии наук Украины. В течение долгого времени заведовал кафедрой биологической химии Крымского медицинского института, является основателем Крымской биохимической школы.
Капилля́рный электрофоре́з, известный также как капиллярный зональный электрофорез, используется для разделения ионов по заряду. В случае обычного электрофореза заряженные молекулы перемещаются в проводящей жидкости под действием электрического поля. В 1960-х годах была предложена методика капиллярного электрофореза для разделения молекул по заряду и размеру в тонком капилляре, заполненном электролитом.
Футпринтинг ДНК — метод поиска в структуре ДНК последовательностей связывания ДНК-связывающих белков. Данный метод используют для изучения взаимодействия белков с ДНК как in vitro, так и in vivo.
Вестерн-блоттинг — аналитический метод, используемый для определения в образце специфичных белков. На первом этапе используют электрофорез белков в полиакриламидном геле для разделения денатурированных полипептидов по длине или по трехмерной структуре белка. Далее белки переносят на нитроцеллюлозную или PVDF-мембрану, затем детектируют с использованием антител, специфичных к заданному белку.

Трицин — органическое соединение, используемое для приготовления буферных растворов. Название «трицин» происходит от слов «трис» и «глицин». Молекула трицина представляет собой цвиттер-ионную аминокислоту, и имеет интервал буферных свойств pH 7.4-8.8.
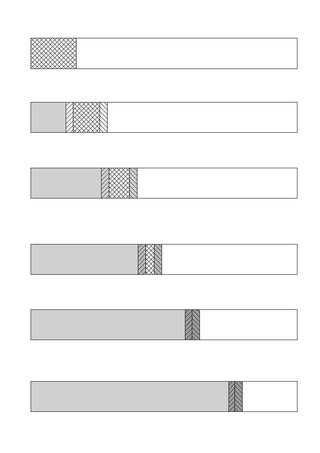
Изотахофорез (ИТФ) — метод разделения различных типов ионов по их подвижности в электрическом поле. При ИТФ все виды ионов мигрируют в одном направлении, образуя набор зон, находящихся в равновесном состоянии и перемещающимися с одинаковыми скоростями.
Блоттинг — общее название методов молекулярной биологии по переносу определённых белков или нуклеиновых кислот из раствора, содержащего множество других молекул, на какой-либо носитель в целях последующего анализа. В одних случаях молекулы предварительно подвергаются гель-электрофорезу, в других — переносятся непосредственно на мембрану. После блоттинга молекулы визуализируются посредством различных методов:
- Окрашивание.
- Авторадиографическая визуализация.
- Специфическое маркирование с помощью иммунохимических методов или гибридизации.
Электрофорез двумерный — процесс разделения сложных связей белков, в котором сочетаются электрофорез белков и изоэлектрическое фокусирование. Метод позволяет изучать структуры, возникающие в сверхспирализованной молекуле кольцевой ДНК.












