Иммуноглобулины M
Иммуноглобули́ны M (IgM) — класс антител. Молекулы IgM являются самыми тяжёлыми (молекулярная масса 990 кДа[1]) и наиболее сложно организованными иммуноглобулинами. Молекула свободного IgM представляет собой пентамер[англ.], каждый мономер которого состоит из двух тяжёлых цепей (μ-цепей) и двух лёгких цепей κ- или λ-типов. Мономеры объединены в пентамер посредством дисульфидных мостиков и J-цепи[англ.][2]. При первичном попадании в организм антигена иммуноглобулины IgM из всех антител образуются первыми[3][4]. Кроме того, они первыми появляются в онто- и филогенезе. У человека и других млекопитающих IgM синтезируются плазматическими клетками, находящимися в селезёнке[5][6]. IgM наиболее активны в антибактериальном иммунитете и при ряде аутоиммунных заболеваний[7].
История изучения
Изучение иммуноглобулинов M началось с опубликованного в 1937 году сообщения о появлении в крови лошадей, гипериммунизированных полисахаридами пневмококка, антител, значительно превосходивших по массе обычные иммуноглобулины G кролика[8]. Из-за большого размера новые антитела сначала получили название «γ-макроглобулины», и возникшее позднее название нового класса антител — IgM — также связано с приставкой macro-. Обычно популяции IgM очень гетерогенны, так как они направлены против самых разных инфекционных агентов; это значительно затрудняло изучение их структуры. Впоследствии были найдены источники гомогенных IgM-антител. Выяснилось, что в некоторых случаях клетки множественной миеломы продуцируют гомогенные IgM[9]. В 1960-х годах были разработаны методы для индукции развития иммуноглобулинпродуцирующих опухолей (плазмацитом[англ.]) у мышей, что позволило получить гомогенные популяции антител многих классов, в том числе и IgM[10].
Структура
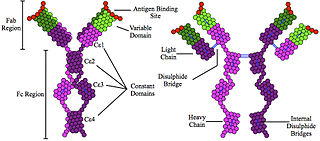
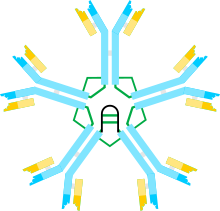
Молекула IgM состоит из пяти мономерных субъединиц, располагающихся радиально, причём их Fc-фрагменты направлены в центр комплекса, а Fab-фрагменты обращены наружу. В каждом мономере тяжёлая цепь (μ-цепь) включает около 576 аминокислотных остатков (а. о.). Она содержит вариабельный домен (VH-домен) длиной около 110 а. о. и четыре константных домена (C-домена), обозначаемых Cμ1, Cμ2, Cμ3 и Cμ4 соответственно, однако в ней отсутствует шарнирный участок. Функционально его частично заменяет домен Cμ2, содержащий в первичной структуре остатки пролина. Существует предположение, что этот домен стал эволюционным предшественником шарнирной области γ- и α-цепей иммуноглобулинов G и A соответственно. Каждый C-домен состоит примерно из 110 а. о. и имеет хвостовой участок длиной около 20 а. о. По данным рентгеноструктурного анализа, остатки пролина в домене Cμ2 обеспечивают Fab-фрагменту гибкость, необходимую для обнаружения антигенных детерминант на поверхности антигенпрезентирующей или бактериальной клетки. Каждая μ-цепь связана с пятью олигосахаридами, присоединёнными к остаткам аспарагина: один «пришит» к домену Cμ1, три — к домену Cμ3 и один — к хвостовой части цепи[11]. Лёгкие цепи представлены λ- или κ-типом, содержат около 220 а. о. и включают вариабельный домен VL (около 110 а. о.) и константный домен CL (около 110 а. о.)[12].
Мономеры соединяются в пентамер посредством дисульфидных мостиков и J-цепи, с которой у каждого пентамера взаимодействует остаток цистеина, локализованный в C-концевом участке мономера. J-цепь представляет собой небольшой кислый белок длиной около 137 а. о. J-цепь связывает две μ-цепь посредством дисульфидных связей. Однако IgM существует не только в пентамерной форме. Известна мономерная форма IgM, которая находится на поверхности B-лимфоцитов и выполняет роль антигенраспознающего рецептора, а свободный IgM, входящий в состав плазмы крови, существует в виде пентамера. Мембранные мономеры отличаются от мономеров, входящих в состав пентамера, числом аминокислотных остатков в хвостовой части аминокислотной цепи[13][14].
Хотя у человека и мыши преобладающей формой IgM является пентамер, у шпорцевых лягушек (Xenopus sp.) IgM существует преимущественно в гексамерной форме[15][16], у костистых рыб — в тетрамерной[англ.] форме. Пентамерная форма IgM преобладает и у хрящевых рыб (например, акул)[17][18]. Причина, по которой IgM человека и мыши существует в основном виде пентамера, неясна, так как теоретически он может формировать и стабильный гексамер[19][20]. Эксперименты на мышах показали, что у них может образовываться гексамерная форма IgM только в случае невозможности взаимодействия μ-цепей с J-цепью (если она не экспрессируется[21] или в μ-цепях отсутствуют остатки цистеина, необходимые для связывания с J-цепью[22][23]). Таким образом, у мыши гексамеры никогда не образуются при наличии J-цепей, а пентамерная форма может существовать как при наличии J-цепи, так и в её отсутствие[24].
С помощью разнообразных методов, таких как рентгеноструктурный анализ и ЯМР-спектроскопия, была установлена структура доменов Cμ1—Cμ4, которые экспрессировали по отдельности в клетках кишечной палочки Escherichia coli. Как и в случае остальных иммуноглобулинов, μ-цепь IgM содержит 7 перекрывающихся бета-листов, стабилизированных междоменными дисульфидными связями. Константный участок IgM по форме похож на шляпочный гриб, в котором домены Cμ2—Cμ3 образуют «шляпку», а домен Cμ4 формирует подобие «ножки»[25].
Функции
IgM — первые иммуноглобулины, которые начинают синтезироваться в плоде человека (примерно на 20-й неделе)[26]. Иммуноглобулины M могут взаимодействовать с компонентом C1[англ.] системы комплемента и активизировать классический путь системы комплемента, в результате чего происходит опсонизация антигенов и цитолиз. IgM взаимодействуют с молекулами полииммуноглобулинового рецептора[англ.] (plgR), благодаря чему попадают на слизистые оболочки, такие как выстилку кишечника, а также в грудное молоко. В этом взаимодействии участвует J-цепь[27]. При трансплантации органов в организме реципиента вырабатываются IgM, направленные против пересаженного органа, однако они не участвуют в реакции отторжения трансплантанта и могут оказывать защитную роль[28]. При первичном столкновении с антигеном IgM образуются первыми, они появляются и при повторных столкновениях, но в меньших количествах. IgM не проходят через плаценту (через неё проходят только иммуноглобулины G). Наличие в плазме крови IgM против определённых возбудителей свидетельствует о ранних этапах инфекции, а в крови новорождённого — о внутриматочной инфекции (например, синдроме врождённой краснухи[англ.]). В норме IgM часто присутствуют с плазме крови в связанном с определёнными антигенами виде, за что их иногда называют «натуральными антителами». Причиной этого явления может служить высокая авидность IgM, из-за чего они связывают антигены с низкой кросс-реактивностью[англ.], встречающиеся в плазме крови здорового человека[29].
Примечания
- ↑ Kabat E. A. THE MOLECULAR WEIGHT OF ANTIBODIES. (англ.) // The Journal Of Experimental Medicine. — 1939. — 1 January (vol. 69, no. 1). — P. 103—118. — doi:10.1084/jem.69.1.103. — PMID 19870830.
- ↑ Галактионов, 2004, с. 65.
- ↑ Immunoglobulin M // The American Heritage Dictionary of the English Language (англ.). — Fourth. — Houghton Mifflin Company[англ.], 2004. — ISBN 978-0618082308.
- ↑ Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. Chapter 24 // Molecular Biology of the Cell (англ.). — 4th. — Routledge, 2002. — ISBN 978-0-8153-3288-6.
- ↑ Capolunghi F., Rosado M. M., Sinibaldi M., Aranburu A., Carsetti R. Why do we need IgM memory B cells? (англ.) // Immunology Letters. — 2013. — May (vol. 152, no. 2). — P. 114—120. — doi:10.1016/j.imlet.2013.04.007. — PMID 23660557.
- ↑ Williams, N.; O'Connell, P. R. Chapter 62 // Bailey & Love's Short Practice of Surgery (англ.). — 25th. — CRC Press, 2008. — P. 1102. — ISBN 9780340939321.
- ↑ Галактионов, 2004, с. 67.
- ↑ Heidelberger M., Pedersen K. O. THE MOLECULAR WEIGHT OF ANTIBODIES. (англ.) // The Journal Of Experimental Medicine. — 1937. — 28 February (vol. 65, no. 3). — P. 393—414. — doi:10.1084/jem.65.3.393. — PMID 19870608.
- ↑ Waldenström Jan. Incipient myelomatosis or «essential« hyperglobulinemia with fibrinogenopenia - a new syndrome? (англ.) // Acta Medica Scandinavica. — 2009. — 24 April (vol. 117, no. 3—4). — P. 216—247. — ISSN 0001-6101. — doi:10.1111/j.0954-6820.1944.tb03955.x.
- ↑ Potter M. The early history of plasma cell tumors in mice, 1954-1976. (англ.) // Advances In Cancer Research. — 2007. — Vol. 98. — P. 17—51. — doi:10.1016/S0065-230X(06)98002-6. — PMID 17433907.
- ↑ Галактионов, 2004, с. 65—66.
- ↑ Monica T. J., Williams S. B., Goochee C. F., Maiorella B. L. Characterization of the glycosylation of a human IgM produced by a human-mouse hybridoma. (англ.) // Glycobiology. — 1995. — March (vol. 5, no. 2). — P. 175—185. — doi:10.1093/glycob/5.2.175. — PMID 7780192.
- ↑ Галактионов, 2004, с. 66—67.
- ↑ Frutiger S., Hughes G. J., Paquet N., Lüthy R., Jaton J. C. Disulfide bond assignment in human J chain and its covalent pairing with immunoglobulin M. (англ.) // Biochemistry. — 1992. — 22 December (vol. 31, no. 50). — P. 12643—12647. — doi:10.1021/bi00165a014. — PMID 1472500.
- ↑ Parkhouse R. M., Askonas B. A., Dourmashkin R. R. Electron microscopic studies of mouse immunoglobulin M; structure and reconstitution following reduction. (англ.) // Immunology. — 1970. — April (vol. 18, no. 4). — P. 575—584. — PMID 5421036.
- ↑ Schwager J., Hadji-Azimi I. Mitogen-induced B-cell differentiation in Xenopus laevis. (англ.) // Differentiation; Research In Biological Diversity. — 1984. — Vol. 27, no. 3. — P. 182—188. — doi:10.1111/j.1432-0436.1984.tb01426.x. — PMID 6334001.
- ↑ Fillatreau S., Six A., Magadan S., Castro R., Sunyer J. O., Boudinot P. The astonishing diversity of Ig classes and B cell repertoires in teleost fish. (англ.) // Frontiers In Immunology. — 2013. — Vol. 4. — P. 28—28. — doi:10.3389/fimmu.2013.00028. — PMID 23408183.
- ↑ Getahun A., Lundqvist M., Middleton D., Warr G., Pilström L. Influence of the mu-chain C-terminal sequence on polymerization of immunoglobulin M. (англ.) // Immunology. — 1999. — July (vol. 97, no. 3). — P. 408—413. — doi:10.1046/j.1365-2567.1999.00797.x. — PMID 10447761.
- ↑ Dolder F. Occurrence, isolation and interchain bridges of natural 7-S immunoglobulin M in human serum. (англ.) // Biochimica Et Biophysica Acta. — 1971. — 29 June (vol. 236, no. 3). — P. 675—685. — PMID 4997811.
- ↑ Eskeland T., Christensen T. B. IgM molecules with and without J chain in serum and after purification, studied by ultracentrifugation, electrophoresis, and electron microscopy. (англ.) // Scandinavian Journal Of Immunology. — 1975. — Vol. 4, no. 3. — P. 217—228. — doi:10.1111/j.1365-3083.1975.tb02620.x. — PMID 807966.
- ↑ Cattaneo A., Neuberger M. S. Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain. (англ.) // The EMBO Journal. — 1987. — September (vol. 6, no. 9). — P. 2753—2758. — PMID 3119328.
- ↑ Davis A. C., Roux K. H., Shulman M. J. On the structure of polymeric IgM. (англ.) // European Journal Of Immunology. — 1988. — July (vol. 18, no. 7). — P. 1001—1008. — doi:10.1002/eji.1830180705. — PMID 3136022.
- ↑ Davis A. C., Roux K. H., Pursey J., Shulman M. J. Intermolecular disulfide bonding in IgM: effects of replacing cysteine residues in the mu heavy chain. (англ.) // The EMBO Journal. — 1989. — September (vol. 8, no. 9). — P. 2519—2526. — PMID 2511005.
- ↑ Collins C., Tsui F. W., Shulman M. J. Differential activation of human and guinea pig complement by pentameric and hexameric IgM. (англ.) // European Journal Of Immunology. — 2002. — June (vol. 32, no. 6). — P. 1802—1810. — doi:10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C. — PMID 12115664.
- ↑ Müller R., Gräwert M. A., Kern T., Madl T., Peschek J., Sattler M., Groll M., Buchner J. High-resolution structures of the IgM Fc domains reveal principles of its hexamer formation. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2013. — 18 June (vol. 110, no. 25). — P. 10183—10188. — doi:10.1073/pnas.1300547110. — PMID 23733956.
- ↑ van Furth R., Schuit H. R., Hijmans W. The immunological development of the human fetus. (англ.) // The Journal Of Experimental Medicine. — 1965. — 1 December (vol. 122, no. 6). — P. 1173—1188. — doi:10.1084/jem.122.6.1173. — PMID 4159036.
- ↑ Johansen F. E., Braathen R., Brandtzaeg P. Role of J chain in secretory immunoglobulin formation. (англ.) // Scandinavian Journal Of Immunology. — 2000. — September (vol. 52, no. 3). — P. 240—248. — doi:10.1046/j.1365-3083.2000.00790.x. — PMID 10972899.
- ↑ McAlister C. C., Gao Z. H., McAlister V. C., Gupta R., Wright Jr. J. R., MacDonald A. S., Peltekian K. Protective anti-donor IgM production after crossmatch positive liver-kidney transplantation. (англ.) // Liver Transplantation : Official Publication Of The American Association For The Study Of Liver Diseases And The International Liver Transplantation Society. — 2004. — February (vol. 10, no. 2). — P. 315—319. — doi:10.1002/lt.20062. — PMID 14762873.
- ↑ Jayasekera J. P., Moseman E. A., Carroll M. C. Natural antibody and complement mediate neutralization of influenza virus in the absence of prior immunity. (англ.) // Journal Of Virology. — 2007. — April (vol. 81, no. 7). — P. 3487—3494. — doi:10.1128/JVI.02128-06. — PMID 17202212.
Литература
- Галактионов В. Г . Иммунология. — М.: Издат. центр «Академия», 2004. — 528 с. — ISBN 5-7695-1260-1.