Хло́рная и́звесть — смешанный хлорид-гипохлорит кальция или техническая смесь гипохлорита, хлорида и гидроксида кальция.

Гидрокси́д ка́льция (гашёная известь, едкая известь) — химическое вещество с формулой Ca(OH)2, сильное основание.

Ка́льций — химический элемент 2-й группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 20.

Oксид кальция — белое кристаллическое вещество, формула CaO. Относится к классу основных оксидов.
Карбона́ты — соли угольной кислоты (H2CO3), также (в органической химии) сложные эфиры угольной кислоты. Неорганические карбонаты подразделяются на средние, или просто карбонаты, содержащие анион СО32−, и кислые (гидрокарбонаты или бикарбонаты), содержащие анион НСО3−. Органические карбонаты имеют общую формулу R−O−С(O)−O−R, могут иметь ациклическое и циклическое строение.

Кальци́т (известковый шпат) — минерал из класса природных карбонатов, одна из природных форм карбоната кальция (CaCO3). Широко распространён в земной коре:
- породообразующий минерал — известняки, мел, мергель, карбонатит;
- самый распространённый биоминерал — основной состав раковин (и эндоскелета) многих беспозвоночных животных, известковых водорослей и костей;
- имеет полиморфные модификации — арагонит, фатерит и другие.

Циани́ды — соли цианистоводородной (синильной) кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы.

Иóдоводорóд — бесцветный удушливый газ, сильно дымит на воздухе. Хорошо растворим в воде, образует азеотропную смесь с Ткип 127 °C и концентрацией HI 57 %. Неустойчив, разлагается при 300 °C.
Гидри́ды — соединения водорода с металлами и с имеющими мeньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом.

Иоди́д на́трия — натриевая соль иодоводородной кислоты.
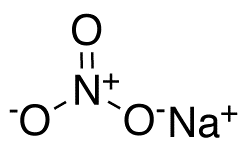
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
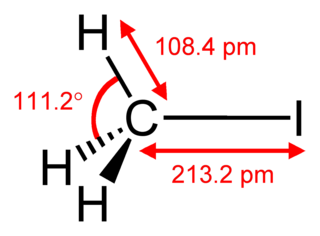
Иодмета́н (ио́дистый мети́л, метилиоди́д, MeI) — органическое соединение с формулой CH3I, продукт замещения иодом одного из атомов водорода в молекуле метана. Тяжёлая летучая жидкость. Часто используется в органическом синтезе для метилирования. В природе выделяется в небольшом количестве рисом.
Соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.

Кальция нитрат, кальциевая селитра, азотнокислый кальций — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Са(NО3)2.
Силикат кальция — неорганическое вещество, соль щелочноземельного металла кальция и метакремниевой кислоты с формулой CaSiO3. Бесцветные кристаллы.
Гипофосфит кальция — неорганическое соединение, соль щелочноземельного металла кальция и фосфорноватистой кислоты с формулой Ca(PH2O2)2, светло-серые кристаллы, растворимые в воде.
Оксид-иодид висмута — неорганическое соединение металла висмута с формулой BiOI, красные прозрачные кристаллы, не растворимые в воде, этаноле и хлороформе.

Карбонат никеля(II) — неорганическое соединение, соль металла никеля и угольной кислоты с формулой NiCO3, жёлтые или зелёные кристаллы, не растворяется в воде, образует кристаллогидраты.

Гексацианоферрат(II) кальция — неорганическое соединение, соль кальция и железистосинеродистой кислоты с формулой Ca2[Fe(CN)6], хорошо растворяется в воде, образует кристаллогидрат — жёлтые кристаллы.
Карботермические реакции включают восстановление веществ, часто оксидов металлов, используя углерод в качестве восстановителя. Эти химические реакции обычно проводятся при температуре в несколько сотен градусов Цельсия. Такие процессы применяются для изготовления свободных химических элементов. Карботермические реакции бесполезны для некоторых оксидов, чаще всего, оксидов активных металлов. Способность металлов участвовать в карботермических реакциях можно предсказать из диаграмм Эллингема.















