История молекулярной биологии

История молекулярной биологии начинается в 1930-х годах с объединения ранее отдельных биологических дисциплин: биохимии, генетики, микробиологии и вирусологии. Кроме того, в надежде, что новая дисциплина откроет возможности понимания фундаментальных основ жизни, в неё пришли многие химики и физики.
Молекулярная биология в современном понимании объясняет феномен жизни, начиная от свойств макромолекул. В особенности в центре внимания молекулярных биологов оказались два их вида: 1) нуклеиновые кислоты, среди которых наиболее известна ДНК, на ней зафиксирована структура генов, и 2) белки, активность которых обеспечивает жизнь на молекулярном уровне. Согласно одному из определений молекулярной биологии, эта дисциплина характеризует структуру, функции и отношения между этими двумя типами макромолекул.
Общий обзор
Название новой дисциплины было предложено Уорреном Уивером, директором отдела естественных наук Фонда Рокфеллера, в 1938 г. Поначалу подразумевалось, что от неё ожидается объяснение физических и химических основ жизни. После того, как в 1910-х годах законы Менделя получили широкое признание в научных кругах, а в 1920-х годах развитие атомной теории привело к разработке принципов квантовой механики, казалось, что наука вплотную подошла к открытию молекулярного фундамента феномена жизни. Уивер от имени Фонда Рокфеллера поддерживал и финансировал исследования на стыке биологии, химии и физики, и даже такие знаменитости, как Нильс Бор и Эрвин Шрёдингер, пытались подвести под биологию теоретическую базу так, как они это делали в теоретической физике. Однако в 1930-х — 1940-х годах не было ясно, какие именно исследования приведут к цели, если эта цель вообще достижима. В том числе проводились исследования в коллоидной химии, биофизике, радиобиологии и кристаллографии.
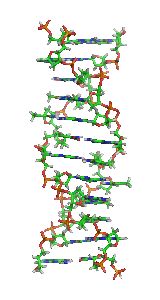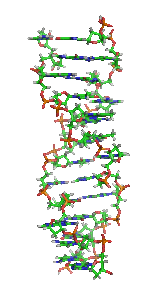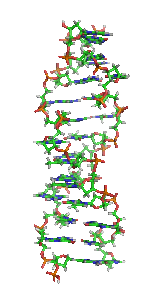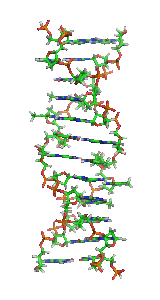
В 1940 г. Джордж Бидл и Эдуард Тейтем показали факт существования связи между генами и белками[1], связав генетику с биохимией. Они предложили генетикам вместо дрозофилы использовать в качестве модельного организма грибок нейроспору. Использование более широкого спектра модельных организмов было чрезвычайно важно для появления новой дисциплины. В 1944 г. Освальд Эвери, работавший в Рокфеллеровском университете с бактериями, показал, что гены состоят из ДНК[2] (см. Эксперимент Эвери, Маклеода и Маккарти). В 1952 г. Алфред Херши и Марта Чейз подтвердили, что генетический материал бактериофага тоже состоит из ДНК[3] (см. Эксперимент Херши — Чейз). В 1953 г. Джеймс Уотсон и Фрэнсис Крик предложили двухспиральную структуру молекулы ДНК[4]. Их структурная модель действительно позволила объяснить многие фундаментальные биологические феномены, такие как существование очень больших биологических молекул, способ хранения и точного копирования информации о их структуре, возможность изменения структуры генов в эволюции и др., в результате чего молекулярная биология обрела свои основные принципы.
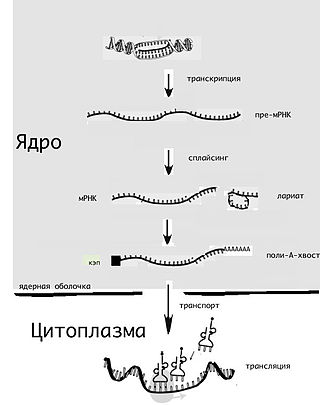
В 1961 г. Франсуа Жакоб и Жак Моно предположили, что между ДНК и белком должен быть посредник, который они назвали информационной РНК. В 1961—1965 гг. с расшифровкой генетического кода стало понятно, как информация, хранящаяся на ДНК, определяет структуру белка, и какие именно сочетания нуклеотидов в структуре ДНК соответствуют определенным аминокислотам белка. В начале 1960-х годов Жакоб и Моно показали также, как белок может регулировать транскрипцию и экспрессию генов[5].
Главные открытия в молекулярной биологии были сделаны на протяжении примерно четверти века. Затем понадобилось ещё пятнадцать лет исследований, прежде чем на их основе были разработаны новые сложные технологии, которые сейчас в совокупности называют генетической инженерией. Они позволили выделять и характеризовать отдельные гены, в том числе из весьма сложно устроенных живых организмов, включая человека.
Исследования молекул
Оценивая молекулярную революцию в контексте истории биологии, нетрудно заметить, что рождение молекулярной биологии было кульминацией длительного процесса, который начался с первых наблюдений, сделанных под микроскопом. Ранние исследователи пытались понять, как функционируют живые организмы на микроскопическом уровне. С конца XVIII в. все большее внимание уделялось описанию особенностей химических молекул, производящихся живыми организмами. Так в трудах выдающихся химиков, таких как Юстус Либих, родилась физиологическая химия, предшественница современной биохимии, в свою очередь, обязанной своим рождением Эдуарду Бухнеру. Однако между молекулами, которые изучали химики, и тонкими структурами, заметными под микроскопом, например, хромосомами, лежала область неизвестного, «мир упущенных измерений», как его называл выдающийся физико-химик Вольфганг Освальд. Этот мир населяли коллоиды, химические соединения, структура и свойства которых оставались неясными.
Успех молекулярных биологов в исследовании этого неизвестного мира обеспечило появление новых методов физики и химии, таких как рентгеноструктурный анализ, электронная микроскопия, ультрацентрифугирование, электрофорез.
Поворотным пунктом в этом процессе стала работа Лайнуса Полинга 1949 г., в которой впервые болезнь человека, серповидноклеточная анемия, была связана с мутацией в молекуле гемоглобина.
Биохимия и генетика
При рождении молекулярной биологии произошла встреча двух дисциплин, переживавших в первой половине XX века период бурного развития: биохимии и генетики. Биохимики изучали структуру и функции молекул, из которых состоит живая материя. Между 1900 и 1940 гг. были описаны центральные процессы метаболизма: пищеварение и усваивание питательных веществ, в частности, углеводов. Каждый из элементарных химических процессов, из которых состоит метаболизм, катализируется особым ферментом. Ферменты — это белки, так же как антитела крови и белки, отвечающие за сокращения мускулатуры. Поэтому изучение структуры и функции белков стало одной из важнейших задач биохимии. Генетики, благодаря введению Томасом Морганом плодовой мушки дрозофилы в качестве модельного организма, установили справедливость законов Менделя и открыли множество новых фактов и закономерностей в отношениях между генами. В частности, Морган показал, что гены локализованы на хромосомах. Тем не менее, химическая природа генов и молекулярные механизмы их действия оставались загадкой.
Исследования биохимии ДНК
Ранние исследования
В 1869 г. Иоганн Фридрих Мишер открыл вещество, которое он назвал нуклеином. Позже он очистил образец из спермы лосося, и в 1889 г. его ученик, Рихард Альтман, назвал его нуклеиновой кислотой. В 1919 г. в Рокфеллеровском институте был проведен химический анализ нуклеиновой кислоты, в составе которой были идентифицированы четыре азотистых основания, сахар и фосфат, соединенные между собой ковалентными связями в порядке фосфат-сахар-основание. Каждая из этих единиц получила название нуклеотид. Однако поначалу предполагалось, что четыре нуклеотида соединены между собой в короткие цепи одинаковой структуры. Лишь в 1934 г. Торбьёрн Касперссон и Эйнар Хаммерстен показали, что ДНК — это полимер.
Хромосомы и наследуемые признаки
В 1927 г. Н. К. Кольцов предположил, что наследуемые признаки должны передаваться из поколения в поколение вместе с гигантскими молекулами, которые состоят из двух зеркальных цепей, реплицируемых полуконсервативным способом, и каждая из цепей при репликации служит матрицей для синтеза новой[6]. В 1935 г. Макс Дельбрюк, Н. В. Тимофеев-Ресовский и Карл Циммер предположили, что хромосомы — это гигантские молекулы, структура которых может быть изменена путём облучения рентгеновскими лучами, что приводит к изменению наследуемых признаков. В 1937 г. Уильям Астбери получил первые результаты рентгеноструктурного анализа ДНК, но не сумел сделать выводы о её структуре. Было только ясно, что эта структура является регулярной.
Критический эксперимент, доказывающий, что гены состоят из ДНК, был поставлен в 1943 г. Освальдом Эвери и его соавторами, которые продолжали работу трагически погибшего в начале Второй мировой войны Фредерика Гриффита со штаммами пневмококков. В экспериментах Гриффита происходила трансформация невирулентных бактерий шероховатого типа (R) в вирулентный гладкий штамм (S). Эвери выделил «трансформирующий принцип» и идентифицировал его как ДНК. Аналогичный эксперимент был поставлен в 1953 г. Алфредом Херши и Мартой Чейз, которые работали с бактериофагом Т2. В своей работе они тоже показали, что генетическим материалом фага является ДНК.
Исследования структуры ДНК
В 1950-х годах три группы ученых добились успеха в исследованиях структуры биологических макромолекул. Первая работала в Кингс-колледже (Лондон), в неё входили Морис Уилкинс и Розалинда Франклин. Вторая состояла из Фрэнсиса Крика и Джеймса Уотсона из Кембриджа. Третья группа, возглавляемая Лайнусом Полингом, работала в Калифорнийском технологическом институте (США). Уотсон и Крик конструировали модели структуры из шариков, соединенных металлическими стержнями, исходя из данных о структуре отдельных нуклеотидов и расстояниях между атомами. Франклин и Уилкинс анализировали данные кристаллографии и рентгеноструктурного анализа.
Группа Полинга в 1948 г. на основании таких же исследований обнаружила, что в пространственной структуре многих белков имеются более или менее крупные части в виде спирали. Аналогичные выводы можно было сделать и на основании данных Франклин и Уилкинса на ДНК. Окончательные выводы о спиралевидной структуре ДНК, наличии в ней двух цепей, связанных между собой водородными связями между отдельными нуклеотидами, обращенными друг к другу, и их комплементарности были сделаны Уотсоном и Криком. Им помог Эрвин Чаргафф, посетивший в 1952 г. Кембридж и напомнивший о своих экспериментах 1947 г., когда он обнаружил, что в разных образцах ДНК соотношение нуклеотидов варьирует, но аденин всегда присутствует в той же пропорции, в какой и тимин, а гуанин — в такой же, как и цитозин.
Первую точную модель ДНК Уотсон и Крик построили в 1953 г. на основании данных, полученных к этому моменту Франклин[7]. Их открытие вызвало необыкновенный энтузиазм как у ученых, так и у широкой публики. Статья Уотсона и Крика была опубликована в Nature 25 апреля. Её содержание было дублировано публичным докладом заведующего лабораторией, в которой работали Уотсон и Крик, Уильяма Брэгга, 14 мая. Уже 15 мая о нём была помещена заметка в лондонской газете News Chronicle, а 16 мая — в The New York Times. В 1962 г. Уотсон, Крик и Уилкинс получили за это открытие Нобелевскую премию. Розалинд Франклин к этому времени уже скончалась от рака в 1958 г.
«Центральная догма»
В 1957 г. Крик предложил формулу, которая получила известность как «центральная догма молекулярной биологии». Согласно этой формуле, ДНК является хранилищем информации о структуре белка. Посредником между ними является РНК. Предполагавшийся механизм полуконсервативной репликации ДНК был к этому времени подтвержден экспериментом Мезельсона и Сталя. Крик и его соавторы показали, что генетический код состоит из нуклеотидных триплетов, названных кодонами, каждый из которых кодирует один аминокислотный остаток белка. К 1966 г. Хар Корана и др. расшифровали генетический код, установив соотношения между кодонами ДНК и аминокислотными остатками белка.
Исследования РНК
Структура
Ранние работы по исследованию структуры РНК также относятся к 1950 м годам. Уотсон и Крик предполагали, что наличие у рибозы 2`OH группы препятствует образованию двойной спирали, характерной только для ДНК[8]. Были сомнения даже в способности этой макромолекулы к образованию любой спиральной структуры. Высокая степень гетерогенности очищенных образцов препятствовала получению на РНК отчетливых снимков дифракционной картины и их рентгеноструктурному анализу. В 1955 г. был открыт фермент полинуклеотидфосфорилаза[9], с помощью которого стал возможен искусственный синтез гомогенных нуклеиновых кислот, и данные рентгеноструктурного анализа значительно улучшились. Оказалось, что РНК не только может образовать спираль, но, как и ДНК, способна к созданию двойной спирали, хотя её структура и отличалась от двойной спирали ДНК.
В конце 1950 — начале 1960-х годов было опубликовано множество результатов исследований РНК, в том числе о гибридизации РНК и ДНК с образованием двойных спиралей из цепей обеих макромолекул[10] и даже тройной спирали РНК[11], а также о структуре небольших фрагментов РНК и динуклеотидов G-C и A-U, кристаллизованных в виде завитков спирали[12]. Современный обзор этих работ был опубликован в 2009 г.[13]
К середине 1960-х годов были открыты рибосомы, показана их роль в синтезе белка и необходимость информационной РНК для их сборки. Кроме информационной РНК и РНК, входящей в структуру рибосом, в синтезе белка участвовали также транспортные РНК, доставляющие аминокислоты к рибосоме[14]. В 1965 г. была определена первичная структура первой транспортной РНК[15], а к 1968 г. сразу несколько групп ученых получили кристаллы транспортных РНК, хотя ещё недостаточно хорошего качества, чтобы стало возможно определить их пространственную структуру[16]. Эта цель стала достижимой благодаря кристаллизации в 1971 г. тРНКPHE из дрожжей[17]. Работа по исследованию пространственной структуры тРНКPHE была закончена к 1973 г.[18] Впоследствии методы этой пионерской работы были применены к кристаллизации и исследованию пространственной структуры и других тРНК[19][20]. Оказалось, что кроме линейной или спиралевидной формы, по крайней мере, такие РНК, как транспортные, как и белки могут иметь компактную глобулярную структуру.
Рибозимы и структура рибосомы
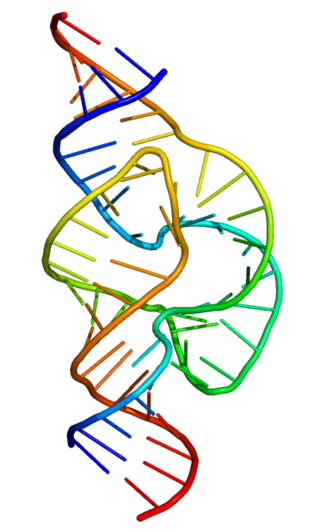
В 1980-х годах было показано, что некоторые РНК способны к аутокаталитическому расщеплению[21][22][23]. РНК, способные, как и ферменты, катализировать химические реакции, такие как аутокаталитическое расщепление, назвали рибозимами. В 1990-х годах у некоторых из рибозимов была изучена пространственная структура[24][25]. Это были первые глобулярные РНК кроме транспортных, у которых стало возможно изучать пространственную структуру. На этой основе далее были проведены исследования особенностей формирования структуры РНК, выявление консервативных структурных мотивов, локальных стабилизирующих взаимодействий между фрагментами нуклеотидной последовательности и т. д.[26]. Эти достижения стали возможными, благодаря появлению метода транскрипции in vitro. Кроме того, для изучения структуры РНК начали применять ядерный магнитный резонанс, который оказался особенно полезен для исследования малых РНК (RNAs)[27][28][29].
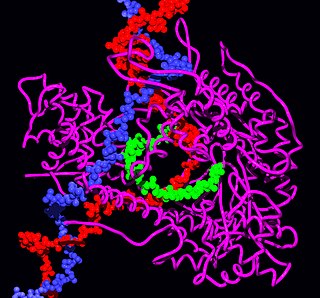
Впоследствии развитие методов изучения структуры РНК позволило исследовать пространственную структуру ещё целого ряда макромолекул этого вида, включая рибосомальную РНК[30][31]. За работу по исследованию пространственной структуры рибосомальной РНК Ада Йонат, Венкатраман Рамакришнан и Томас Стейц получили Нобелевскую премию.
Исследования структуры белка
Первое выделение и классификация
Как особый класс биологических молекул, белки были определены ещё в XVIII в. Антуаном де Фуркруа. Вначале их называли альбуминами (matières albuminoides, albuminoids или Eiweisskörper) и их характерными свойствами считали способность к свертыванию или коагуляции при обработке теплом или кислотой. Широко известными примерами таких белков к началу XIX в. считали яичный альбумин, альбумин из сыворотки крови, фибрин и клейковину пшеницы. Сходство между свертыванием яичного белка и створаживанием молока было известно с древнейших времен. Даже само слово альбумин было предложено ещё Плинием Старшим и происходит от латинского выражения albus ovi (белок яичный).
Якоб Берцелиус и Геррит Ян Мульдер провели элементный анализ растительных и животных белков и пытались определить их эмпирическую формулу. К их удивлению, у всех белков формула оказалась приблизительно одинаковой: C400H620N100O120, различными были лишь содержание серы и фосфора, присутствовавшие в относительно небольших пропорциях. Мульдер предполагал, что существует единая базовая белковая субстанция (Grundstoff), которая синтезируется в растениях и усваивается животными при переваривании. Берцелиус поддержал эту идею, назвав субстанцию протеином.
Я предложил наименование протеин для органического оксида фибрина и альбумина, я хотел бы произвести это слово от греческого πρωτειος, потому что он представляется примитивной или принципиальной субстанцией пищеварения у животных.
Оригинальный текст (англ.)The name protein that I propose for the organic oxide of fibrin and albumin, I wanted to derive from the Greek word πρωτειος, because it appears to be the primitive or principal substance of animal nutrition.Оригинальный текст (фр.)Le nom protéine que je vous propose pour l’oxyde organique de la fibrine et de l’albumine, je voulais le dériver de πρωτειος, parce qu’il paraît être la substance primitive ou principale de la nutrition animale.— Из личной переписки Берцелиуса от 10 июля 1838 г.
Мульдер также идентифицировал продукты деградации протеина, в частности, аминокислоту лейцин, и определил её молекулярную массу, 131 Da.
Очистка и определение массы
Минимальная молекулярная масса протеина, согласно анализу Мульдера, была примерно 9 kDa, в сотни раз больше, чем у большинства других молекул, с которыми ему доводилось сталкиваться. Поэтому химическая структура протеина (точнее, первичная структура) оставалась неизвестной до 1949 г., когда Фредерик Сенгер определил аминокислотную последовательность первого белка, которым был инсулин. Однако теоретически ещё в 1902 г. Франц Хофмайстер и Эмиль Фишер предсказали, что белки представляют собой линейную цепь из аминокислотных остатков, соединенных пептидными связями. Многие ученые сомневались, что столь длинные аминокислотные цепи могут оставаться стабильными в растворе, и существовали также альтернативные теории о возможном строении белков. Например, согласно коллоидной гипотезе, белки состоят из циклолов.
То, что белки все-таки являются макромолекулами с определенной структурой, а не коллоидными смесями, показал Теодор Сведберг с помощью аналитического ультрацентрифугирования. При помощи очистки из ткани трудно получить белок в количестве более, чем несколько миллиграммов. Поэтому ранние исследования проводили на протеинах, легко очищаемых из яичного белка, крови, а также различных токсинов и пищеварительных соков, получаемых со скотобоен. Техника очистки белка быстро развивалась во время Второй мировой войны в связи с необходимостью получать очищенные белки крови для лечения раненых солдат. В конце 1950 г. американская компания Armour and Company очищала в больших количествах рибонуклеазу А и бесплатно предоставляла её для исследований. В результате РНКаза А на несколько десятилетий стала основным объектом фундаментальных исследований для множества научных групп. В частности, на ней было сделано несколько работ, удостоенных Нобелевской премии.
Пространственная структура
Исследования пространственной структуры белка начались в 1910-х годах, когда Крик и Мартин показали, что при коагуляции выпадению белка в осадок предшествует другой процесс, денатурация, при которой белок теряет растворимость и ферментативную активность, но приобретает дополнительные химические свойства. В середине 1920-х годов было отмечено, что иногда денатурация может быть обратимой и изменение свободной энергии при этом процессе существенно меньше, чем при обычных химических реакциях, а к 1929 г. появились представления о том, что денатурация представляет собой изменение конформации аминокислотной цепи, при которой остатки, ранее находившиеся внутри белковой глобулы, теперь экспонированы в растворитель. В таком случае растворимость должна понижаться в соответствии со сравнительно низкой растворимостью аминокислот с алифатическими и ароматическими боковыми группами. Соответственно появляются дополнительные химические свойства и утрачивается ферментативная активность.
В начале 1960 г. Кристиан Анфинсен показал, что РНКаза А действительно денатурирует обратимо, и что естественная конформация этого белка соответствует глобальному минимуму свободной энергии.
Когда структура белка ещё не была известна, Дороти Ринч и Ирвинг Ленгмюр для обоснования гипотезы о циклолах предположили, что эти структуры стабилизируются за счет гидрофобных связей. Хотя идею о гидрофобных взаимодействиях поддержал сам Джон Бернал, она в 1930-х годах была отвергнута вместе с гипотезой о циклолах Лайнусом Полингом и другими исследователями. Полинг был сторонником водородных связей, теорию которых развивал Уильям Астбери. Несмотря на то, что роль водородных связей в стабилизации структуры белка в конце концов оказалась незначительной, это не помешало Полингу верно сформулировать представления об основных структурных элементах белка, альфа-спиралях и бета-складках. Значимость гидрофобных связей прояснилась лишь к 1959 г., когда было показано, что ионизация части аминокислотных остатков, показанная ещё Арне Тиселиусом, играет роль лишь на поверхности белковой глобулы, где полипептидная цепь входит в контакт с растворителем.
Пространственную структуру глобулярных белков вначале изучали лишь гидродинамическими методами и ультрацентрифугированием. В 1950-х годах появились спектральные методы, включая круговой дихроизм, флуоресценцию, определение спектров поглощения в ультрафиолетовой и инфракрасной областях. Кристаллография и рентгеноструктурный анализ для определения пространственной структуры гемоглобина были впервые применены Перуцом и Кендрю в 1960-х годах. За эту работу они были удостоены Нобелевской премии. В 1980-х годах начали также применять ядерный магнитный резонанс. К 2006 г. Protein Data Bank содержал данные о пространственной структуре 40 тысяч белков. Благодаря выявлению консервативных доменов, гомологичные структуры разных белков теперь можно реконструировать при помощи компьютерных программ, а для исследования структуры больших межбелковых комплексов применяют криоэлектронную микроскопию.
См. также
Литература
- Fruton, Joseph. Proteins, Genes, Enzymes: The Interplay of Chemistry and Biology. New Haven: Yale University Press. 1999. ISBN 0-300-07608-8
- Lily E. Kay, The Molecular Vision of Life: Caltech, the Rockefeller Foundation, and the Rise of the New Biology, Oxford University Press, Reprint 1996
- Morange, Michel. A History of Molecular Biology. Cambridge, MA: Harvard University Press. 1998.
Примечания
- ↑ Beadle, G. W.; Tatum, E. L. Genetic Control of Biochemical Reactions in Neurospora (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1941. — Vol. 27, no. 11. — P. 499—506. — doi:10.1073/pnas.27.11.499. — PMID 16588492. — PMC 1078370.
- ↑ Avery, Oswald T.; Colin M. MacLeod, Maclyn McCarty. Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types: Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated from Pneumococcus Type III (англ.) // Journal of Experimental Medicine[англ.] : journal. — Rockefeller University Press[англ.], 1944. — 1 February (vol. 79, no. 2). — P. 137—158. — doi:10.1084/jem.79.2.137. — PMID 19871359. — PMC 2135445. Архивировано 7 октября 2008 года.
- ↑ http://jgp.rupress.org/cgi/content/abstract/36/1/39 Архивная копия от 27 марта 2010 на Wayback Machine Hershey, A.D. and Chase, M. (1952) Independent functions of viral protein and nucleic acid in growth of bacteriophage. J Gen Physiol.
- ↑ Watson J.D. and Crick F.H.C. A Structure for Deoxyribose Nucleic Acid (англ.) // Nature. — 1953. — Vol. 171, no. 4356. — P. 737—738. — doi:10.1038/171737a0. — . — PMID 13054692. Архивировано 4 февраля 2007 года.
- ↑ Jacob, F; Monod, J. Genetic regulatory mechanisms in the synthesis of proteins (англ.) // J Mol Biol[англ.] : journal. — 1961. — Vol. 3. — P. 318—356. — PMID 13718526.
- ↑ Soyfer V.N. The consequences of political dictatorship for Russian science (англ.) // Nat. Rev. Genet. : journal. — 2001. — September (vol. 2, no. 9). — P. 723—729. — doi:10.1038/35088598. — PMID 11533721.
- ↑ Watson J., Crick F. Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid (рум.) // Nature. — 1953. — Т. 171, nr. 4356. — P. 737—738. — doi:10.1038/171737a0. — . — PMID 13054692. Архивировано 23 августа 2014 года.
- ↑ Watson J.D., Crick F.H. Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid (рум.) // Nature. — 1953. — Aprilie (т. 171, nr. 4356). — P. 737—738. — doi:10.1038/171737a0. — . — PMID 13054692. Архивировано 4 февраля 2007 года.
- ↑ Grunberg-Manago M., Ortiz P.J., Ochoa S. Enzymatic synthesis of nucleic acidlike polynucleotides (англ.) // Science : journal. — 1955. — November (vol. 122, no. 3176). — P. 907—910. — doi:10.1126/science.122.3176.907. — PMID 13274047.
- ↑ Rich A., Davies D.R. A new, two-stranded helical structure: polyadenylic acid and polyuridylic acid (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1956. — July (vol. 78, no. 14). — P. 3548—3549. — doi:10.1021/ja01595a086.
- ↑ Felsenfeld G., Davies D.R., Rich A. Formation of a three-stranded polynucleotide molecule (англ.) // J. Am. Chem. Soc.[англ.] : journal. — 1957. — April (vol. 79, no. 8). — P. 2023—2024. — doi:10.1021/ja01565a074.
- ↑ Sobll H., Tomita K., Rich A. The crystal structure of an intermolecular complex containing a guanine and a cytosine derivative (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1963. — June (vol. 49, no. 6). — P. 885—892. — doi:10.1073/pnas.49.6.885. — PMID 13989773. — PMC 300027.
- ↑ Rich A. The era of RNA awakening: structural biology of RNA in the early years (англ.) // Q. Rev. Biophys. : journal. — 2009. — May (vol. 42, no. 2). — P. 117—137. — doi:10.1017/S0033583509004776. — PMID 19638248.
- ↑ Warner J.R., Rich A. The number of soluble RNA molecules on reticulocyte polyribosomes (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1964. — June (vol. 51, no. 6). — P. 1134—1141. — doi:10.1073/pnas.51.6.1134. — PMID 14215634. — PMC 300225.
- ↑ Holley, R.W., Apgar, J., Everett, G.A., Madison, J.T., Marguisse, M., Merrill, S.H., Penwick, J.R., Zamir. Structure of a ribonucleic acid (англ.) // Science. — 1965. — March (vol. 147, no. 3664). — P. 1462—1465. — doi:10.1126/science.147.3664.1462. — PMID 14263761.
- ↑ Kim S.H., Rich A. Single crystals of transfer RNA: an X-ray diffraction study (англ.) // Science : journal. — 1968. — December (vol. 162, no. 3860). — P. 1381—1384. — doi:10.1126/science.162.3860.1381. — PMID 4880852.
- ↑ Kim S.H., Quigley G., Suddath F.L., Rich A. High-resolution x-ray diffraction patterns of crystalline transfer RNA that show helical regions (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1971. — April (vol. 68, no. 4). — P. 841—845. — doi:10.1073/pnas.68.4.841. — PMID 5279525. — PMC 389056.
- ↑ Kim S.H., Quigley G.J., Suddath F.L., McPherson A., Sneden D., Kim J.J., Weinzierl J., Rich A. Three-dimensional structure of yeast phenylalanine transfer RNA: folding of the polynucleotide chain (англ.) // Science : journal. — 1973. — January (vol. 179, no. 4070). — P. 285—288. — doi:10.1126/science.179.4070.285. — . — PMID 4566654.
- ↑ Drew H.R., Wing R.M., Takano T., Broka C., Tanaka S., Itakura K., Dickerson R.E. Structure of a B-DNA dodecamer: conformation and dynamics (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1981. — April (vol. 78, no. 4). — P. 2179—2183. — doi:10.1073/pnas.78.4.2179. — PMID 6941276. — PMC 319307.
- ↑ Shen L.X., Cai Z., Tinoco I. RNA structure at high resolution (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 1995. — August (vol. 9, no. 11). — P. 1023—1033. — PMID 7544309.
- ↑ Cech T.R., Zaug A.J., Grabowski P.J. In vitro splicing of the ribosomal RNA precursor of Tetrahymena: involvement of a guanosine nucleotide in the excision of the intervening sequence (англ.) // Cell : journal. — Cell Press, 1981. — December (vol. 27, no. 3 Pt 2). — P. 487—496. — doi:10.1016/0092-8674(81)90390-1. — PMID 6101203.
- ↑ Stark B.C., Kole R., Bowman E.J., Altman S. Ribonuclease P: an enzyme with an essential RNA component (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1978. — August (vol. 75, no. 8). — P. 3717—3721. — doi:10.1073/pnas.75.8.3717. — PMID 358197. — PMC 392857.
- ↑ Prody G.A., Bakos J.T., Buzayan J.M., Schneider I.R., Bruening G. Autolytic Processing of Dimeric Plant Virus Satellite RNA (англ.) // Science : journal. — 1986. — March (vol. 231, no. 4745). — P. 1577—1580. — doi:10.1126/science.231.4745.1577. — PMID 17833317.
- ↑ Pley H.W., Flaherty K.M., McKay D.B. Three-dimensional structure of a hammerhead ribozyme (англ.) // Nature : journal. — 1994. — November (vol. 372, no. 6501). — P. 68—74. — doi:10.1038/372068a0. — PMID 7969422.
- ↑ Cate J.H., Gooding A.R., Podell E., Zhou K., Golden B.L., Kundrot C.E., Cech T.R., Doudna J.A. Crystal structure of a group I ribozyme domain: principles of RNA packing (англ.) // Science : journal. — 1996. — September (vol. 273, no. 5282). — P. 1678—1685. — doi:10.1126/science.273.5282.1678. — PMID 8781224.
- ↑ Ferré-D'Amaré A.R., Doudna J.A. RNA folds: insights from recent crystal structures (англ.) // Annu Rev Biophys Biomol Struct : journal. — 1999. — Vol. 28, no. 1. — P. 57—73. — doi:10.1146/annurev.biophys.28.1.57. — PMID 10410795.
- ↑ Ramos A., Gubser C.C., Varani G. Recent solution structures of RNA and its complexes with drugs, peptides and proteins (англ.) // Curr. Opin. Struct. Biol. : journal. — 1997. — June (vol. 7, no. 3). — P. 317—323. — doi:10.1016/S0959-440X(97)80046-2. — PMID 9204272.
- ↑ Butcher S.E., Dieckmann T., Feigon J. Solution structure of a GAAA tetraloop receptor RNA (англ.) // EMBO J. : journal. — 1997. — December (vol. 16, no. 24). — P. 7490—7499. — doi:10.1093/emboj/16.24.7490. — PMID 9405377. — PMC 1170348.
- ↑ Costa M., Michel F. Frequent use of the same tertiary motif by self-folding RNAs (англ.) // EMBO J. : journal. — 1995. — March (vol. 14, no. 6). — P. 1276—1285. — PMID 7720718. — PMC 398207.
- ↑ PDB 3BWP; Toor N., Keating K.S., Taylor S.D., Pyle A.M. Crystal structure of a self-spliced group II intron (англ.) // Science : journal. — 2008. — April (vol. 320, no. 5872). — P. 77—82. — doi:10.1126/science.1153803. — PMID 18388288.; rendered with PyMOL Архивная копия от 2 августа 2019 на Wayback Machine
- ↑ PDB 1FFK; Ban N., Nissen P., Hansen J., Moore P.B., Steitz T.A. The complete atomic structure of the large ribosomal subunit at 2.4 A resolution (англ.) // Science : journal. — 2000. — August (vol. 289, no. 5481). — P. 905—920. — doi:10.1126/science.289.5481.905. — PMID 10937989.; rendered with PyMOL Архивная копия от 2 августа 2019 на Wayback Machine