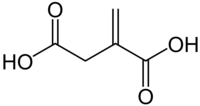
Итаконовая кислота
| Итаконовая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | 3-карбоксибут-3-еновая кислота |
| Хим. формула | C5H6O4 |
| Рац. формула | HOOC-CH2(C=CH2)COOH |
| Физические свойства | |
| Молярная масса | 130.099 г/моль |
| Плотность | 1,573 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 166,5 °C |
| • кипения | 381 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 3,85[1] и 5,45[1] |
| Классификация | |
| Рег. номер CAS | 97-65-4 |
| PubChem | 811 |
| Рег. номер EINECS | 202-599-6 |
| SMILES | |
| InChI | |
| ChEBI | 30838 |
| ChemSpider | 789 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Итако́новая кислота́ (метиленбутандиовая кислота, метиленянтарная кислота) — непредельная двухосновная карбоновая кислота[2]. Соли и эфиры итаконовой кислоты называются итаконатами.
Будучи α,β-ненасыщенной карбонильной кислотой, итаконовая кислота способна вступать в сопряжённое присоединение по Михаэлю в качестве акцептора, что делает возможным использовать её в промышленности как мономерное звено в синтезе полимеров. Так, итаконовая кислота применяется как сомономер в производстве карбоксилатных каучуков, используется для получения пиролидонов, бутиролактона, метилбутандиола, детергентов, гербицидов, стирен-бутадиеновых полимеров, нитрильных латексов, растворителей.
Итаконовая кислота (итаконат) также синтезируется некоторыми организмами путём декарбоксилирования аконитовой кислоты (аконитата). Итаконат, продуцируемый клетками млекопитающих, играет важную роль в процессе воспаления[3].
Промышленное производство
Итаконовая кислота может быть получена при перегонке лимонной кислоты. Мировое производство превышает 40 тыс. тонн в год. Ожидается, что к 2020 году продажа итаконовой кислоты возрастет до 410 тыс. тонн в год[4]. Главными потребителями этого продукта являются химические компании — производители полимеров. Предполагается рост спроса на итаконовую кислоту в связи с планируемым запретом на транспортировку акрилонитрила в Европе.
Продукция итаконата грибами
Итаконат продуцируется некоторыми аскомицетами из рода Aspergillus (A. itaconicus, A. térreus), а также базидиомицетами Ustilago maydis. У грибов итаконат продуцируется из аконитата в цитоплазме, а затем покидает клетку с помощью специальных переносчиков. И Aspergillus, и U. maydis имеют митохондриальные переносчики, транспортирующие цис-аконитат, промежуточное соединение цикла Кребса, из митохондрии в цитоплазму. В случае Aspergillus, цис-аконитат декарбоксилируется до итаконата, который выходит из клетки в среду с помощью переносчика MfsA, принадлежащего к суперсемейству трансмембранных белков MFS (major facilitator superfamily). В случае U. maydis цис-аконитат также транспортируется из митохондрий в цитоплазму, где он изомеризуется в транс-аконитат, который декарбоксилируется до итаконата. Итаконат также может покидать клетку с помощью переносчика Itp1, принадлежащего к суперсемейству MFS[5].
Начавшийся в 30-е годы XX века стремительный рост полимерной промышленности положил начало развитию биотехнологического производства итаконата. Итаконат, продуцируемый Aspergillus, по сей день является важным биотехнологическим продуктом[6]. Тем не менее, несмотря на интенсивное изучение итаконата в контексте биотехнологии, его биологическая функция в грибах до сих пор до конца не известна[5].
Иммунорегуляторные свойства итаконата
Продукция итаконата макрофагами
В 2011 было показано, что итаконат продуцируется в культуре активированных макрофагов[7][8] и в лёгких при инфекции Mycobacterium tuberculosis[9].
В отличие от грибов, в клетках млекопитающих итаконат продуцируется непосредственно в митохондриях, при этом он опосредует эффекты как в митохондриях, так и в цитоплазме клетки и даже вне клетки. Будучи гидрофильной молекулой, итаконат не может свободно перемещаться через мембраны. По-видимому, итаконат транспортируется из митохондрий в цитоплазму за счёт работы переносчика α-кетоглутарата[10]. Транспорт итаконата через плазмолему подтвержден экспериментально, однако специфических переносчиков итаконата на настоящий момент не описано.
Механизмы действия итаконата
Антибактериальная активность
Итаконат является ингибитором изоцитратлиазы (ИЦЛ)[11][12][13], фермента глиоксилатного цикла, метаболического пути, который используют бактерии, простейшие, грибы и растения. Глиоксилатный цикл во многом схож с циклом Кребса, однако не включает себя реакции декарбоксилирования, тем самым позволяет избежать потерю CO2, в связи с чем даёт значительное преимущество микроорганизмам, например, при ограничении доступа к глюкозе.
Итаконат также способен ингибировать пропионил-КоА карбоксилазу (PCC)[14]. Пропионил-КоА является в том числе конечным продуктом метаболизма жирных кислот с нечётным числом атомов углерода, а его карбоксилирование до метилмалонил-КоА — первым этапом на пути его превращения в сукцинил-КоА и вовлечения в цикл Кребса.
В совокупности, итаконат способен препятствовать использованию жирных кислот в качестве субстрата. Это может быть критично для микроорганизмов, существующих в среде без глюкозы; в среде, лишенной глюкозы, итаконат подавляет рост Pseudomonas indigofera[12][15] и Rhodospirillum rubrum[14] за счёт подавления ИЦЛ и PCC соответственно.
С недостатком глюкозы сталкиваются в том числе и внутриклеточные паразиты, в связи с чем некоторые патогены активно используют глиоксилатный цикл. Так, Mycobacterium tuberculosis активно экспрессирует ИЦЛ при попадании в клетку, тогда как подавление фермента способствует удалению бактерий из легких[16]. Эксперименты in vitro показали, что итаконат способен подавлять рост M. tuberculosis и Salmonella enterica[17]. Важность непосредственного противомикробного эффекта итаконата подтверждается тем фактом, что многие патогенные микроорганизмы, такие как Micrococcus sp.[18], Salmonella sp.[19], Yersinia pestis и Pseudomonas aeruginosa[20], выработали способность метаболизировать итаконат до пирувата и ацетил-КоА.
Ингибирование сукцинатдегидрогеназы
Итаконат имеет структурное сходство с другими метаболитами, за счёт чего он может выступать как конкурентный ингибитор ферментов, использующих эти метаболиты в качестве субстратов. Так, сходство итаконата и сукцината было отмечено ещё в первой половине XX века, на основании чего итаконат был выбран как потенциальный ингибитор сукцинатдегидрогеназы (СДГ). Действительно, в ранних работах итаконат упоминается как ингибитор СДГ in vitro[21][22][23] и in vivo[24]. Итаконат, продуцируемый макрофагами в ответ на LPS, подавляет субстратное фосфорилирование в том числе за счёт подавления СДГ[25][26].
Примечания
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 5—95. — ISBN 978-1-4987-5428-6
- ↑ Итаконовая кислота : [арх. 21 октября 2022] / Огибин Ю. Н. // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Peace, Christian G., Luke AJ O’Neill. The role of itaconate in host defense and inflammation (англ.) // The Journal of clinical investigation : Журнал. — 2022. — Vol. 132, no. 2. Архивировано 15 февраля 2024 года.
- ↑ Top value platform chemicals: bio-based production of organic acids
- ↑ 1 2 Wierckx, N., Agrimi, G., Lübeck, P.S., Steiger, M.G., Mira, N.P., Punt, P.J. Metabolic specialization in itaconic acid production: a tale of two fungi (англ.) // Current opinion in biotechnology : Журнал. — 2020. — Vol. 62. — P. 153—159. Архивировано 15 февраля 2024 года.
- ↑ Cunha da Cruz, J., Machado de Castro, A., Camporese Sérvulo, E. F. World market and biotechnological production of itaconic acid (англ.) // 3 Biotech : Журнал. — 2018. — Vol. 8. — P. 1—15.. Архивировано 15 февраля 2024 года.
- ↑ Sugimoto, M., Sakagami, H., Yokote, Y., Onuma, H., Kaneko, M., Mori, M., Sakaguchi, Y., Soga, T., Tomita, M. Non-targeted metabolite profiling in activated macrophage secretion (англ.) // Metabolomics. — 2012. — Vol. 8, no. 4. — P. 624—633.
- ↑ Strelko, C.L., Lu, W., Dufort, F.J., Seyfried, T.N., Chiles, T.C., Rabinowitz J.D., Roberts M.F. Itaconic acid is a mammalian metabolite induced during macrophage activation (англ.) // J. Am. Chem. Soc.. — 2011. — Vol. 133, no. 41. — P. 16386—16389.
- ↑ Shin, J.H., Yang, J.Y., Jeon, B.Y., Yoon, Y.J., Cho, S.N., Kang, Y.H., Ryu, D.H., Hwang, G.S. 1H NMR-based metabolomic profiling in mice infected with Mycobacterium tuberculosis (англ.) // J. Proteome Res.. — 2011. — Vol. 10, no. 5. — P. 2238—2247.
- ↑ Mills EL, Ryan DG, Prag HA, Dikovskaya D, Menon D, Zaslona Z, Jedrychowski MP, Costa ASH, Higgins M, Hams E, Szpyt J, Runtsch MC, King MS, McGouran JF, Fischer R, Kessler BM, McGettrick AF, Hughes MM, Carroll RG, Booty LM, Knatko EV, Meakin PJ, Ashford MLJ, Modis LK, Brunori G, Sévin DC, Fallon PG, Caldwell ST, Kunji ERS, Chouchani ET, Frezza C, Dinkova-Kostova AT, Hartley RC, Murphy MP, O'Neill LA. Itaconate is an anti-inflammatory metabolite that activates Nrf2 via alkylation of KEAP1 (англ.) // Nature : Журнал. — 2018. Архивировано 6 февраля 2024 года.
- ↑ Rao G. R., McFadden B. A. Isocitrate lyase from Pseudomonas indigofera: IV. Specificity and inhibition (англ.) // Archives of Biochemistry and Biophysics. — 1965. — Vol. 112, no. 2. — P. 294—303.
- ↑ 1 2 Williams J.O. Mechanism of Action of Isocitrate Lyase from Pseudomonas indigofera (англ.) // Biochem. J.. — 1971. — Vol. 10, no. 8. — P. 1384—1390..
- ↑ Rittenhouse J. W., McFadden B. A. Inhibition of isocitrate lyase from Pseudomonas indigofera by itaconate (англ.) // Archives of biochemistry and biophysics. — 1974. — Vol. 163, no. 1. — P. 79—86.
- ↑ 1 2 Berg I.A., Filatova L. V, Ivanovsky R.N. Inhibition of acetate and propionate assimilation by itaconate via propionyl-CoA carboxylase in isocitrate lyasenegative purple bacterium Rhodospirillum rubrum (англ.) // FEMS Microbiol. Lett.. — 2002. — Vol. 216, no. 1. — P. 49—54.
- ↑ McFadden B.A., Purohit S. Itaconate, an isocitrate lyase directed inhibitor in Pseudomonas indigofera (англ.) // J. Bacteriol.. — 1977. — Vol. 131, no. 1. — P. 136—144.
- ↑ Muñoz-Elías E.J., McKinney J.D. Mycobacterium tuberculosis isocitrate lyases 1 and 2 are jointly required for in vivo growth and virulence (англ.) // Nat. Med.. — 2005. — Vol. 11, no. 6. — P. 638—644.
- ↑ Michelucci, A., Cordes, T., Ghelfi, J., Pailot, A., Reiling, N., Goldmann, O., Binz, T., Wegner, A., Tallam, A., Rausell, A., Buttini M., Linster C.L., Medina E., Balling R., Hiller K. Immune-responsive gene 1 protein links metabolism to immunity by catalyzing itaconic acid production (англ.) // Proc. Natl. Acad. Sci. U. S. A.. — 2013. — Vol. 110, no. 19. — P. 7820—7825.
- ↑ Cooper R.A., Kornberg H.L. The utilization of itaconate by Pseudomonas sp. (англ.) // Biochem. J.. — 1964. — Vol. 91, no. 1. — P. 82—91.
- ↑ Martin W.R., Frigan F., Bergman E.H. Noninductive Metabolism of Itaconic Acid By Pseudomonas and Salmonella Species (англ.) // J. Bacteriol.. — 1961. — Vol. 82, no. 6. — P. 905—908.
- ↑ Sasikaran J., Ziemski M., Zadora P.K., Fleig A., Berg I.A. Bacterial itaconate degradation promotes pathogenicity (англ.) // Nat. Chem. Biol.. — 2014. — Vol. 10, no. 5. — P. 371—377.
- ↑ Ackermann W.W., Potter V.R. Enzyme Inhibition in Relation to Chemotherapy (англ.) // Proc. Soc. Exp. Biol. Med.. — 1949. — Vol. 72, no. 1. — P. 1—9.
- ↑ Dervartanian D.V., Veeger C. Studies on succinate dehydrogenase: I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes (англ.) // Biochimica et Biophysica Acta (BBA)-Specialized Section on Enzymological Subjects. — 1964. — Vol. 92, no. 2. — P. 233—247.
- ↑ Dervartanian D.V., Veeger C. Studies on succinate dehydrogenase. II. On the nature of the reaction of competitive inhibitors and substrates with succinate dehydrogenase (англ.) // Biochimica et Biophysica Acta (BBA)-Enzymology and Biological Oxidation. — 1965. — Vol. 105, no. 3. — P. 424—436.
- ↑ Booth N., Taylor J. The Inhibitory Effects of Itaconic Acid in vitro and in vivo (англ.) // J. Biol. Chem.. — 1951. — Vol. 195. — P. 697—702.
- ↑ Németh, B., Doczi, J., Csete, D., Kacso, G., Ravasz, D., Adams, D., Kiss, G., Nagy, A. M., Horvath, G., Tretter, L., Mócsai, A., Csépányi-Kömi, R., Iordanov, I., Adam-Vizi, V., Chinopoulos, C. Abolition of mitochondrial substrate‐level phosphorylation by itaconic acid produced by LPS‐induced Irg1 expression in cells of murine macrophage lineage (англ.) // The FASEB Journal. — 2016. — Vol. 30, no. 1. — P. 286—300.
- ↑ Lampropoulou V., Sergushichev A., Bambouskova M., Nair S., Vincent E.E., Loginicheva E., Cervantes-Barragan L., Ma X., Huang S.C.C., Griss T., Weinheimer C.J., Khader S., Randolph G.J., Pearce E.J., Jones R.G., Diwan A., Diamond M.S., Artyomov M.N. Itaconate Links Inhibition of Succinate Dehydrogenase with Macrophage Metabolic Remodeling and Regulation of Inflammation (англ.) // Cell Metab.. — 2016. — Vol. 24, no. 1. — P. 158—166.