Карбоксисомы

Карбоксисо́мы (полиэдральные тела) — микрокомпартменты в клетках бактерий, содержащие фиксирующие углерод ферменты[1]. Они представляют собой многогранные однослойные белковые тела полиэдрической формы от 80 до 140 нанометров в диаметре. Они являются основной частью механизма концентрирования CO2, что помогает преодолеть неэффективность рибулозодифосфаткарбоксилазы (Рубиско) — главного фермента, лимитирующего скорость фиксации углерода в цикле Кальвина. Эти органеллы обнаружены во всех цианобактериях и многих хемотрофных бактериях, фиксирующих CO2[2].
Карбоксисомы являются примером большой группы микрокомпартментов, имеющих разные функции, но сходное строение, основанное на гомологии двух семейств мембранных белков[3].
История открытия
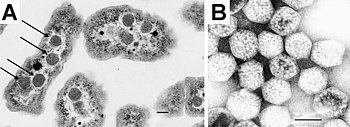
Впервые карбоксисомы были обнаружены при помощи электронной микроскопии в 1956 году у цианобактерии Phormidium uncinatum[2][4], а позже в 1960-х годах сходные многогранные объекты были обнаружены и у других цианобактерий[5]. В 1961 году эти структуры были названы полиэдральными телами, и в последующие несколько лет они были открыты у некоторых хемотрофных бактерий, которые фиксируют диоксид углерода (например, Halothiobacillus[англ.], Acidithiobacillus[англ.], Nitrobacter[англ.] и Nitrococcus). Из-за сходства карбоксисом с фаговыми частицами учёные долгое время скептически относились к мысли, что они могут быть функциональными органеллами бактериальной клетки. Однако этот скептицизм быстро прошёл, когда в 1973 году Джессап Шивли (Jessup Shively) и его сотрудники из университета Клемсона[англ.] выделили карбоксисомы из Thiobacillus neapolitanus, после чего в них было показано наличие Рубиско и отсутствие ДНК[6]. Авторы предложили назвать эти органеллы карбоксисомы, поскольку новые органеллы были вовлечены в фиксацию углерода[7].
Архитектура


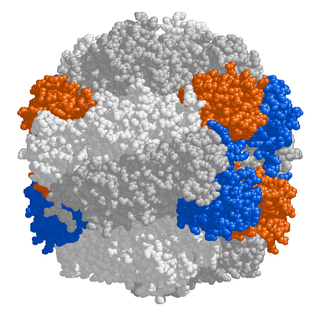
Структурно карбоксисомы являются двадцатигранниками или квази-икосаэдрами, обычно приблизительно от 80 до 120 нанометров в диаметре[8]. Карбоксисома имеет внешнюю мембрану, состоящую из нескольких тысяч субъединиц белка, который заключает в капсулу два фермента, карбоангидразу и рибулозодифосфаткарбоксилазу[9].
Существует два вида карбоксисом: α-карбоксисомы и β-карбоксисомы, которые отличаются по своему белковому составу. В α-карбоксисомах содержится Рубиско I типа, которое распределено несколькими слоями, а гены, ответственные за синтез белков карбоксисомы, организованы в один оперон. В β-карбоксисомах содержится Рубиско II типа, у которой нет малых регуляторных субъединиц и организованные в плотную паракристаллическую структуру при помощи специального белка, а её гены образуют несколько независимых кластеров. Цианобактерии с α-карбоксисомами обитают в среде, где количество растворённого углекислого газа не ограничено (например, олиготрофные океанические воды), в то время как цианобактерии с β-карбоксисомами обитают там, где растворённый углекислый газ в среде лимитирован (бактериальные маты, эстуарии рек, щелочные озера с высокой плотностью фотосинтезирующих организмов)[10].
Структура α-карбоксисом
Рентгеноструктурный анализ показал, что внешняя оболочка карбоксисомы состоит из шестиугольных белков[9]. У разных видов бактерий α-карбоксисомы построены из разного количества видов белков, от 8 до 11. Основную структурную функцию в α-карбоксисомах несут белки CsoS1A, CsoS1B и CsoS1C, однако, поры в них слишком малы, чтобы обеспечить диффузию субстрата. Это маленькие белки весом от 10 до 11 кДа. Белок CsoS1D имеет поры, способные открываться и закрываться, которые служат для облегчения поступления субстрата (бикарбоната и рибулозо-1,5-бисфосфата), и выхода продуктов реакции (3-фосфоглицерат). Положительно заряженные остатки аргинина способствуют диффузии несущих отрицательный заряд продукта и субстрата. Другие малочисленные компоненты представляют собой пятиугольные белки CsoS4AB, располагающиеся по углам икосаэдра. Фиксация Рубиско осуществляется посредством взаимодействия белков оболочки карбоксисомы с её малой субъединицей.
В целом, карбоксисома имеет форму гигантского футбольного мяча, сшитого из шести- и пятиугольников[8]. Помимо основных, в состав карбоксисом может входить множество дополнительных белков, имеющих схожую форму, но другое строение. Например, несколько углов такого шестиугольного белка может быть больше или меньше остальных. Полагают, что эти белки ответственны за физическое взаимодействие карбоксисом между собой[11]. Такие карбоксисомы обнаружены у α-цианобактерий, таких, как Synechococcus sp. или хемоавтотрофа Halothiobacillus neapolitanus, ряда сероокисляющих бактерий рода Thiobacillus, Halothiobacillus, Acidithiobacillus и Thiomonas, а также у нитрификаторов рода Nitrobacter, Nitrosomonas и Nitrococcus и азотофикаторов рода Bradyrhizobium. Подвержено наличие этой разновидности карбоксисом у рода из актинобактерий Acidimicrobium[12].
Структура β-карбоксисом
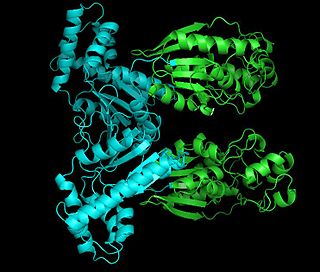
Структурные белки этого вида карбоксисом подразделяют на структурные белки внешнего слоя (CcmK2-4, CcmL и CcmO) и белки внутреннего слоя — CcmM-58, CcmM-35, Рубиско II, caA, CcmN и CcmO. Белок CcmM-58 с массой 58 кДа несёт на своём N-конце последовательность, гомологичную γ-карбоангидразе, а С-конец CcmM-35 с массой 35 кДа несёт три копии белкового домена идентичного малой субъединице Рубиско. Оба эти белка вносят значительный вклад в упаковку углеродфиксирующего фермента внутри карбоксисомы. Как уже упоминалось выше, для построения карбоксисомы необходим пятиугольный белок, который закрывал бы углы икоэсаэдра. В β-карбоксисомах эту функцию выполняет CcmL. В отличие от α-карбоксисом β-карбоксисомы имеют двухслойное строение, что хорошо видно при применении электронной микроскопии, и несколько большие размеры (175 нм в диаметре против 120 нм). Такие карбоксисомы обнаружены у β-цианобактерий таких, как S. elongatus и Synechocystis[12].
Свойства и функции в клетке
Карбоксисомы являются частью эффективного концентрирующего механизма, который позволяет автотрофным бактериям эффективно усваивать CO2 практически в любых условиях. Бикарбонат (HCO3−) транспортируется в клетку при помощи активного транспорта, а затем поступает в карбоксисому. Там карбоангидраза и сдвиг pH ускоряют превращает HCO3− в CO2, который фиксируется Рубиско в виде 3-фосфоглицерата. Таким образом, создаётся локальное повышение концентрации углекислого газа в месте наиболее высокой концентрации Рубиско. Количество клеток, содержащих карбоксисомы, увеличивается по мере того, как количество неорганического углерода (HCO3−, CO2) в среде уменьшается[10][13].
Помимо обычных карбоксисом, содержащих углеродфиксирующие ферменты, существует по крайней мере семь видов этих вирусоподобных структур, выполняющих различные функции. Некоторые из них были найдены у нефотосинтезирующих бактерий, где они были вовлечены в различные каталитические реакции, связанные с выделением углерода, метаболизмом азота и получением энергии. Так, например, Escherichia coli, Klebsiella, Clostridium, Fusobacterium, Shigella, Listeria и Yersinia используют такие микрокомпартменты для выделения углерода с целью получения энергии, разлагая 1,2-пропандиол, этаноламин или оба эти вещества[14]. Примечательно, что Salmonella enterica, при росте на пропандиоле удалось показать наличие в карбоксисомах ключевого фермента этого процесса — диолдегидротазу. Поскольку у всех этих бактерий отсутствует фиксация неорганического углерода, обнаруженные в них микрокомпартменты было решено обозначить как энтеросомы[13]. Примечателен также факт, что образование энетеросом у бактерий происходит в момент заражения животных или человека, что прямо указывает на их связь с патогенностью микроорганизма.
Косвенно значение карбоксисом для клетки подтвердили исследования, в которых карбоксисомы в цианобактериях пометили молекулами зелёного флуоресцентного белка. Оказалось, что карбоксисомы располагаются по прямым линиям, что способствует их равному распределению при делении клетки[15].
Значение в эволюции микроорганизмов
Многие вирусные капсиды также состоят из шестиугольных и пятиугольных белков. Исследования методом электронной криотомографии подтвердили приблизительно двадцатигранную геометрию карбоксисомы и визуализировали молекулы ферментов внутри, расположенные в нескольких концентрических слоях[16][17]. Кроме того, недвадцатигранные формы некоторых карбоксисом можно объяснить в пределах вариации теории гетерогенных тонких мембран[18]. Поскольку карбоксисомы структурно весьма схожи с вирусами по внешнему виду и строению, а также из-за поступавших на ранних этапах сообщениях о выделении из них ДНК, у многих учёных возник соблазн связать происхождение карбоксисом с бактериофагами. Однако, последующие исследования опровергли эти выводы, поскольку выяснилось, что ДНК, якобы выделенная из икосаэдрических тел, на самом деле оказалась частью бактериального нуклеоида[3][14].
Учёные полагают, что карбоксисомы появились в процессе эволюции цианобактерий как адаптация к пониженной концентрации CO2, тем более, что в воде CO2 диффундирует в десять тысяч раз медленнее, чем в воздухе, а его растворимость сильно зависит от pH. К тому же Рубиско крайне чувствителен к высоким концентрациям кислорода, который является прямым конкурентом за его активный центр, поэтому особо остро встал вопрос о его изоляции и защите. Совместно с карбоксисомами происходила эволюция высоко специфичных транспортёров и насосов для иона HCO3-. Такие механизмы концентрирования как CO2 позволили цианобактериям успешно освоить большое количество экологических ниш и распространиться практически во всех водных местах обитания[12].
Примечания
- ↑ Badger M. R., Price G. D. CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution. (англ.) // Journal of experimental botany. — 2003. — Vol. 54, no. 383. — P. 609—622. — PMID 12554704.
- ↑ 1 2 Yeates T. O., Kerfeld C. A., Heinhorst S., Cannon G. C., Shively J. M. Protein-based organelles in bacteria: carboxysomes and related microcompartments. (англ.) // Nature reviews. Microbiology. — 2008. — Vol. 6, no. 9. — P. 681—691. — doi:10.1038/nrmicro1913. — PMID 18679172.
- ↑ 1 2 Cannon G. C., Bradburne C. E., Aldrich H. C., Baker S. H., Heinhorst S., Shively J. M. Microcompartments in prokaryotes: carboxysomes and related polyhedra. (англ.) // Applied and environmental microbiology. — 2001. — Vol. 67, no. 12. — P. 5351—5361. — doi:10.1128/AEM.67.12.5351-5361.2001. — PMID 11722879.
- ↑ DREWS G., NIKLOWITZ W. Cytology of Cyanophycea. II. Centroplasm and granular inclusions of Phormidium uncinatum (нем.) // Archiv fur Mikrobiologie. — 1956. — Vol. 24, № 2. — P. 147—162. — PMID 13327992.
- ↑ Gantt E., Conti S. F. Ultrastructure of blue-green algae. (англ.) // Journal of bacteriology. — 1969. — Vol. 97, no. 3. — P. 1486—1493. — PMID 5776533.
- ↑ Shively J. M., Ball F., Brown D. H., Saunders R. E. Functional organelles in prokaryotes: polyhedral inclusions (carboxysomes) of Thiobacillus neapolitanus. (англ.) // Science (New York, N.Y.). — 1973. — Vol. 182, no. 4112. — P. 584—586. — PMID 4355679.
- ↑ Shively J. M., Ball F. L., Kline B. W. Electron microscopy of the carboxysomes (polyhedral bodies) of Thiobacillus neapolitanus. (англ.) // Journal of bacteriology. — 1973. — Vol. 116, no. 3. — P. 1405—1411. — PMID 4127632.
- ↑ 1 2 Tanaka S., Kerfeld C. A., Sawaya M. R., Cai F., Heinhorst S., Cannon G. C., Yeates T. O. Atomic-level models of the bacterial carboxysome shell. (англ.) // Science (New York, N.Y.). — 2008. — Vol. 319, no. 5866. — P. 1083—1086. — doi:10.1126/science.1151458. — PMID 18292340.
- ↑ 1 2 Kerfeld C. A., Sawaya M. R., Tanaka S., Nguyen C. V., Phillips M., Beeby M., Yeates T. O. Protein structures forming the shell of primitive bacterial organelles. (англ.) // Science (New York, N.Y.). — 2005. — Vol. 309, no. 5736. — P. 936—938. — doi:10.1126/science.1113397. — PMID 16081736.
- ↑ 1 2 Lee, 2008, p. 39.
- ↑ Cheryl A. Kerfeld, William B. Greenleaf, and James N. Kinney. The Carboxysome and Other Bacterial Microcompartments (англ.) : journal. Архивировано 2 апреля 2015 года. Архивированная копия. Дата обращения: 27 февраля 2015. Архивировано 2 апреля 2015 года.
- ↑ 1 2 3 Benjamin D. Rae, Benedict M. Long, Murray R. Badger and G. Dean Price. Functions, Compositions, and Evolution of the Two Types of Carboxysomes: Polyhedral Microcompartments That Facilitate CO2 Fixation in Cyanobacteria and Some Proteobacteria (англ.) // Microbiology and Molecular Biology Reveiwes : journal. — 2013. — September (vol. 77, no. 3). — P. 357—379. — doi:10.1128/MMBR.00061-12.
- ↑ 1 2 Winkenbach F., Wolk C. P. Activities of enzymes of the oxidative and the reductive pentose phosphate pathways in heterocysts of a blue-green alga. (англ.) // Plant physiology. — 1973. — Vol. 52, no. 5. — P. 480—483. — PMID 16658588.
- ↑ 1 2 Philip Hunter. Not so simple after all. A renaissance of research into prokaryotic evolution and cell structure // EMBO reports. — 2008. — Vol. 9. — P. 224—226. — doi:10.1038/embor.2008.24. Архивировано 23 октября 2012 года.
- ↑ Elizabeth Dougherty. Plot of Bacterial Factories Advances Blueprint for Clean Energy // HMS News. — 2010. Архивировано 6 февраля 2015 года.
- ↑ Schmid M. F., Paredes A. M., Khant H. A., Soyer F., Aldrich H. C., Chiu W., Shively J. M. Structure of Halothiobacillus neapolitanus carboxysomes by cryo-electron tomography. (англ.) // Journal of molecular biology. — 2006. — Vol. 364, no. 3. — P. 526—535. — doi:10.1016/j.jmb.2006.09.024. — PMID 17028023.
- ↑ Iancu C. V., Ding H. J., Morris D. M., Dias D. P., Gonzales A. D., Martino A., Jensen G. J. The structure of isolated Synechococcus strain WH8102 carboxysomes as revealed by electron cryotomography. (англ.) // Journal of molecular biology. — 2007. — Vol. 372, no. 3. — P. 764—773. — doi:10.1016/j.jmb.2007.06.059. — PMID 17669419.
- ↑ Vernizzi G., Sknepnek R., Olvera de la Cruz M. Platonic and Archimedean geometries in multicomponent elastic membranes. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2011. — Vol. 108, no. 11. — P. 4292—4296. — doi:10.1073/pnas.1012872108. — PMID 21368184.
Литература
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп. — М.: Издательский центр «Академия», 2012. — С. 46. — 384 с. — ISBN 978-5-7695-7979-0.
- Lee R. E. Phycology. — 4th edition. — Colorado State University, USA: Cambridge University Press, 2008. — 547 p. — ISBN 9780521682770.