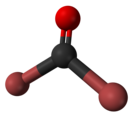
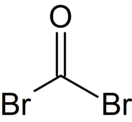Бром — химический элемент 17-й группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 35.

Броми́д ка́лия — неорганическое соединение, калиевая соль бромоводородной кислоты с химической формулой KBr. Имеет вид бесцветного кристаллического вещества.

Бро́моводоро́д — неорганическое вещество, бинарное соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.

Бромид цинка (англ. Zinc bromide) — химическое соединение с формулой ZnBr2. Имеет много общего с хлоридом цинка ZnCl2, в частности, высокую растворимость в воде и органических растворителях. Гигроскопичен, образует дигидрат ZnBr2•2H2O.

Броми́д бери́ллия (бро́мистый бери́ллий) — химическое соединение с формулой BeBr2. Очень гигроскопично и хорошо растворимо в воде, этиловом спирте и диэтиловом эфире.

Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула  . Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.

Трибромид бора (BBr3) — неорганическое соединение, бесцветная или слегка желтоватая жидкость. Соединение очень нестабильное, дымится на воздухе, активно реагирует с водой с образованием борной кислоты и бромоводорода, при смешивании с метанолом на воздухе последний загорается.

Броми́д серебра́ — светло-жёлтое кристаллическое вещество, нерастворимое в воде, имеет ионное строение.
Тиоцианат серебра(I) (AgSCN) — белого цвета, при нагревании разлагается. Не растворяется в воде. Кристаллогидратов не образует. Разлагается концентрированными кислотами и щелочами. Переводится в раствор за счет комплексообразования.

Броми́д ме́ди(I) — неорганическое вещество с формулой CuBr, соединение меди и брома. Относится к классу бинарных соединений, может рассматриваться как соль одновалентной меди и бромоводородной кислоты. В чистом виде — белое кристаллическое вещество, примеси бромида меди(II) окрашивают его в зеленоватый цвет.

Броми́д дирту́ти(2+), также дибромид диртути и бромид ртути(I) — неорганическое вещество с формулой  , соединение ртути и брома. Относится к классу бинарных соединений, является солью, образованной катионом Hg22+ и анионом бромоводородной кислоты. Кристаллическое вещество светло-жёлтого цвета.
, соединение ртути и брома. Относится к классу бинарных соединений, является солью, образованной катионом Hg22+ и анионом бромоводородной кислоты. Кристаллическое вещество светло-жёлтого цвета.

Броми́д це́зия — CsBr, неорганическое бинарное соединение цезия и брома, цезиевая соль бромоводородной кислоты. Бесцветное вещество с ионной структурой; нелетучее, термически устойчивое, хорошо растворимое в воде. Кристаллическая решётка CsBr — кубическая объемноцентрированная типа CsCl.

Бромид таллия — бинарное неорганическое соединение, соль металла таллия и бромистоводородной кислоты с формулой TlBr, светло-жёлтые кристаллы, плохо растворимые в воде.

Бромид олова(IV) — неорганическое соединение, соль металла олово и бромистоводородной кислоты с формулой SnBr4, бесцветные (белые) гигроскопичные кристаллы, образует кристаллогидрат.

Бромид аммония — неорганическое соединение, соль аммония и бромистоводородной кислоты с формулой NH4Br, бесцветные кристаллы, растворимые в воде. При нагревании сублимируется и разлагается. Устойчив на свету и на воздухе (при полном отсутствии примесей). Хорошо растворяется в воде (гидролиз по катиону). Не образует кристаллогидратов.
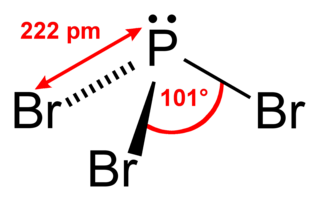
Бромид фосфора(III) — бинарное неорганическое соединение брома и фосфора с формулой PBr3, бесцветная жидкость, реагирует с водой.

Бромид фосфора(V) — бинарное неорганическое соединение брома и фосфора с формулой PBr5, жёлто-оранжевые кристаллы, реагирует с водой.

Монобромид иода — бинарное неорганическое соединение иода и брома с формулой IBr, чёрно-коричневые кристаллы, реагирует с водой.

Броми́д руби́дия — неорганическое соединение, соль рубидия и бромистоводородной кислоты с химической формулой RbBr.
Электрофил — реагент или молекула, имеющая свободную орбиталь на внешнем электронном уровне. Как правило такие реагенты являются акцепторами пары электронов при образовании химической связи с нуклеофилом, являющимся донором электронной пары и вытесняет уходящую группу в виде положительно заряженной частицы. Все электрофилы являются кислотами Льюиса.