
Немета́ллы — химические элементы, как правило, не обладающие свойствами металлов. Занимают правый верхний угол Периодической системы элементов Менделеева и обычно отделены линией (лесенкой). Количество неметаллов составляет 22-23 элемента, в зависимости от классификации.

Мета́ллы — группа химических элементов, обладающих в виде простых веществ при нормальных условиях характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и характерный металлический блеск.
Химическая связь — взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи — прочность, длина, полярность, устойчивость.

Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью . Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
Бори́ды — бинарные соединения бора с более электроположительными химическими элементами, в частности с металлами. Известны для большинства элементов подгрупп 1-12 (Ia-IIа и IIIб-VIIIб), а также для Аl, Si, As, P. Некоторые элементы подгрупп 11-12 (Iб-IIб) образуют бинарные системы с высоким содержанием бора (например, CuB22, ZnB22), которые относят не к химическим соединениям, а к твердым растворам.
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.

Вале́нтность — способность атомов образовывать определённое количество химических связей, которые образует атом, или число атомов, которое может присоединить или заместить атом данного элемента.

Карбони́лы мета́ллов, карбони́льные_ко́мплексы — координационные комплексы переходных металлов с монооксидом углерода, являющегося лигандом. Многие карбонилы металлов очень летучи.

Ковале́нтная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.

Ко́мплексные соедине́ния или координацио́нные соедине́ния — это соединения, которые образуются в результате присоединения к данному иону, называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений была предложена в 1893 г. А. Вернером.
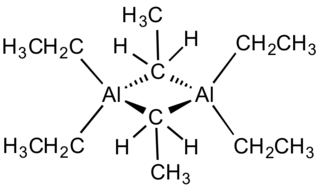
Металлоорганические соединения (МОС) — органические соединения, в молекулах которых существует связь атома металла с атомом/атомами углерода. Цианиды, карбиды, а в некоторых случаях и карбонилы металлов, также содержащие связь металл—углерод, считают неорганическими соединениями. К металлоорганическим соединениям иногда относят органические соединения бора, кремния, фосфора, мышьяка, селена и теллура, поскольку строение и свойства органических соединений с участием этих элементов во многих аспектах сходны с химией родственных им металлорганических соединений алюминия, германия и др. ; однако более точным в этом случае является более общий термин элементорганические соединения, получивший распространение в России и странах бывшего СССР.

Циклоалка́ны (также полиметиленовые углеводороды, нафтены, цикланы, или циклопарафины) — циклические насыщенные углеводороды, относятся к насыщенным карбоциклическим соединениям. Могут содержать боковые цепи, содержащие углеводородные (алкильные) заместители, соединенные с циклом. Все атомы углерода циклоалканов находятся в sp3-гибридизированном состоянии. Моноциклические (содержащие один цикл) циклоалканы образуют гомологические ряды с общей формулой CnH2n. Простейшим циклоалканом является циклопропан(цикло-С3H6). По числу атомов углерода в цикле циклоалканы делят на малые – циклопропан и циклобутан, обычные – циклопентан, циклогексан и циклогептан, средние – от циклооктана (8 атомов углерода) до циклододекана (12 атомов углерода), большие – с 13 и более атомами в карбоцикле.
Бо̀роводоро́ды — химические соединения бора с водородом. Отличаются высокой химической активностью и чрезвычайно большой теплотой сгорания. Представляют интерес как ракетное топливо. В органическом синтезе находит применение реакция присоединения борана и некоторых алкилборанов к двойной связи алкенов с вовлечением полученных соединений в дальнейшие превращения.
Алифатические соединения в органической химии — соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи или замкнутые. Иногда к алифатическим соединениям относят только ациклические, а алициклические выделяют в отдельный класс.
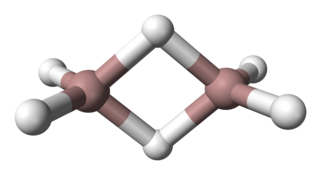
Дигалла́н, или гидрид галлия(III), — неорганическое бинарное химическое соединение галлия и водорода. Химическая формула — Ga2H6.

Фазы Лавеса — самый многочисленный класс интерметаллических соединений. Подавляющее большинство двойных фаз Лавеса имеют стехиометрический состав AB2, хотя имеются малочисленные исключения из этого правила.
Адаманзаны — каркасные трициклические тетрамины, в которых четыре мостиковых атома азота соединены шестью алкильными цепями. Формально адаманзаны являются гомологами гексаметилентетрамина (тетраазаадамантана), в которых атомы азота расположены в вершинах тетраэдра, а алкильные цепи — вдоль его ребер.
Борогидриды (боранаты, тетрагидридобораты, тетрагидробораты) — неорганические комплексные соединения, содержащие группу борогидридную [BH4]-, бесцветные кристаллические вещества, растворимые в воде, жидком аммиаке, аминах.
Органические пероксиды — соединения состава ROOR', содержащие пероксидную группу O-O и являющиеся органическими производными пероксида водорода, в молекуле которого оба атома водорода замещены на углеводородные радикалы.
Правила Уэйда, англ. Polyhedral skeletal electron pair theory — набор правил подсчета электронов, позволяющих предсказать структуры кластерных соединений, таких как бораны и карбораны. Эти правила впервые были сформулированы Кеннетом Уэйдом в 1971 году и затем доработаны Майклом Мингосом и другими исследователями. Правила основаны на представлениях теории молекулярных орбиталей о химической связи.












