
Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.

Иммуноферментный анализ — лабораторный иммунологический метод качественного или количественного определения различных низкомолекулярных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала. Теоретические основы ИФА опираются на современную иммунохимию и химическую энзимологию, знание физико-химических закономерностей реакции антиген-антитело, а также на основные принципы аналитической химии.

В биологии активный центр — это область фермента, где молекулы субстрата связываются и подвергаются химической реакции. Активный центр состоит из аминокислотных остатков, которые образуют временные связи с субстратом, и остатков, которые катализируют реакцию этого субстрата. Хотя активный центр занимает только ~ 10-20 % от объёма фермента он является наиболее важной частью, поскольку он непосредственно катализирует химическую реакцию. Обычно активный центр состоит из трех-четырех аминокислот, в то время как другие аминокислоты в белке необходимы для поддержания его третичной структуры.
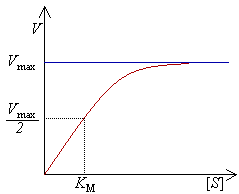
Уравне́ние Михаэ́лиса — Ме́нтен — уравнение наиболее известной модели ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата при определённых общепринятых допущениях. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен, опубликовавших в 1913 году статью, в которой они провели математический анализ ферментативной кинетики. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:

Шифр КФ, или код фермента, англ. EC number — классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для стандартизации исследований.

Комплемента́рность — взаимное соответствие молекул биополимеров или их фрагментов, обеспечивающее образование связей между пространственно взаимодополняющими (комплементарными) фрагментами молекул или их структурных фрагментов вследствие супрамолекулярных взаимодействий.
Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь —СО—NH— между аминокислотами в белках. Делятся на две группы:
- экзопротеазы — выделяются организмом во внешнюю среду ;
- эндопротеазы — находятся внутри клеток.
Абзимы — каталитически активные антитела. В широком смысле термином «абзимы» обычно называют моноклональные каталитически активные антитела, обладающие свойствами ферментов — то есть катализирующие определённые химические реакции.
Семе́йство GH97 гликози́л-гидрола́з — семейство каталитических доменов белков, обладающих гликозил-гидролазными активностями. Также включает гомологичные им домены, возможно не обладающие такими активностями. Всего известно более 100 белков, содержащих домены семейства GH97, большинство из них принадлежит бактериям. У белков этого семейства описано две ферментативные активности: α-глюкозидазная и α-галактозидазная. В пределах семейства GH97 выделяют пять основных подсемейств (GH97a-GH97e). Для белков этого семейства характерна консервативная доменная структура: наряду с центральным каталитическим доменом GH97 обычно присутствуют ещё 2 дополнительных домена, образующие эволюционно консервативный модуль. Необычным свойством этого семейства является то, что среди его представителей имеются ферменты как обращающие (inverting), так и сохраняющие (retaining) путём двойного обращения оптическую конфигурацию субстрата у продукта реакции гидролиза.
Ферментативный катализ — это увеличение скорости процесса с помощью биологической молекулы, «фермента». Большинство ферментов представляют собой белки, и большинство таких процессов представляют собой химические реакции. Внутри фермента катализ обычно происходит в локализованном центре, называемом активным центром.
Термин «число оборотов» может иметь одно из двух родственных значений:

Ферментати́вная кине́тика — зависимость скорости химической реакции от её условий — раздел биохимии, предметом которого являются химические реакции, катализируемые ферментами, изучающий закономерности течения во времени и механизм ферментативных реакций. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагентов, количественным изучением эффектов варьирования условий (кинетики) той или иной химической реакции, а также измеряет её скорость. Изучение ферментов позволяет выявить каталитический механизм действия определённого фермента и контролировать его роль в процессе обмена веществ, способного замедлять (ингибировать) или ускорять (активировать) ход химической реакции. Таким образом, кинетические исследования позволяют не только определить сродство и специфичность связывания субстратов и ингибиторов к ферментам, но и найти максимальную скорость процесса, катализируемого специфическим ферментом, а также попутно решить многие другие задачи и возникающие проблемы. При этом, основная часть проблем ферментативной кинетики сводится к:
- анализу предполагаемых схем ферментативных реакций,
- выводу уравнений скорости, соответствующих этим схемам,
- сопоставлению полученных зависимостей с данными эксперимента.
Оксигеназы — ферменты, катализирующие реакции присоединения одного (монооксигеназы) либо двух (диоксигеназы) атомов кислорода к молекуле субстрата, источником кислорода в этом случае является молекулярный кислород; являются подклассом класса оксидоредуктаз.
Транскетолазы — группа ферментов пентозофосфатного пути и цикла Кальвина. Они катализирует две важные реакции, которые действуют в противоположных направлениях в этих двух путях.

НАДФ-зависимая декарбоксилирующая малатдегидрогеназа или НАДФ-малик-энзим (НАДФ-МЭ) представляет собой фермент, катализирующий химическую реакцию в присутствии двухвалентных ионов металлов:
- (S)-малат + НАДФ+ -> пируват + CO2 + НАДФН
Ферменты промышленного назначения — это ферменты, которые коммерчески используются в различных отраслях промышленности, таких как фармацевтика, химическое производство, производство биотоплива, производство продуктов питания и напитков, а также как потребительские товары. Благодаря достижениям последних лет в процессах биокатализа с использованием изолированных ферментов, их производство считается более экономичным, чем использование целых клеток-продуцентов. В последние годы промышленный биологический катализ с помощью ферментов быстро рос благодаря их способности функционированию в мягких условиях и исключительной хиральной и стереоспецифичности, чего не хватает традиционным химическим процессам. Выделенные ферменты обычно используются в реакциях гидролиза и изомеризации. Цельные клетки обычно используются, когда реакция протекает с участием молекул кофактора. Хотя кофакторы могут генерироваться in vitro, обычно более рентабельно использовать метаболически активные клетки.
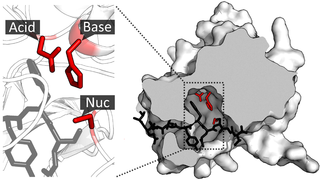
Каталитическая триада — это набор из трех скоординированных аминокислот, которые можно найти в активном центре некоторых ферментов. Каталитические триады чаще всего встречаются в ферментах гидролаз и трансфераз. Триада кислота-основание-нуклеофил является распространенным мотивом для образования нуклеофильного остатка для ковалентного катализа. Остатки образуют сеть реле заряда для поляризации и активации нуклеофила, который атакует субстрат, образуя ковалентный промежуточный продукт, который затем гидролизуется с высвобождением продукта и регенерацией свободного фермента. Нуклеофилом чаще всего является аминокислота серин или цистеин, но иногда треонин или даже селеноцистеин. Трехмерная структура фермента объединяет триадные остатки в точной ориентации, даже если они могут находиться далеко друг от друга в последовательности.
Ферментный промискуитет (неразборчивость) — это способность фермента катализировать случайную побочную реакцию в дополнение к своей основной реакции. Хотя ферменты являются чрезвычайно специфическими катализаторами, они часто могут выполнять побочные реакции в дополнение к своей основной природной каталитической активности. Побочная активность фермента обычно протекает медленнее по сравнению с основной деятельностью и находится под нейтральным отбором. Несмотря на то, что обычно эти активности физиологически нерелевантны, в условиях нового избирательного давления эти виды деятельности могут принести пользу, тем самым побуждая эволюцию ранее побочных активностей стать новым основным видом деятельности. Примером этого является хлоргидролаза атразина (кодируется atzA) Pseudomonas sр., произошедшая из меламиндезаминазы, которая имеет очень небольшую побочную активность в отношении атразина, химического вещества, созданного руками человека.
Лингвальная липаза является членом семейства пищеварительных ферментов, называемых триацилглицеринлипазами, которые используют каталитическую триаду аспартата, гистидина и серина для гидролиза средних и длинноцепочечных триглицеридов до частичных глицеридов и свободных жирных кислот. Фермент, попадающий в рот вместе со слюной, катализирует первую реакцию переваривания пищевых липидов, причём диглицериды являются основным продуктом реакции. Однако из-за уникальных характеристик лингвальной липазы, в том числе оптимума pH 4,5-5,4 и её способности катализировать реакции без солей жёлчных кислот, липолитическая активность распространяется и на желудок. Высвобождение фермента сигнализируется вегетативной нервной системой после приёма внутрь, в это время серозные железы под окружными и листовыми язычными сосочками на поверхности языка выделяют лингвальную липазу в бороздки окружных и листовидных сосочков, локализованных вместе с рецепторы вкуса жира. Гидролиз пищевых жиров важен для всасывания жира в тонком кишечнике, так как длинноцепочечные триацилглицериды не могут абсорбироваться, и до 30 % жира гидролизуется в течение 1-20 минут после приёма одной только лингвальной липазой.
В энзимологии 1-алкил-2-ацетилглицерофосфохолинэстераза (Шифр КФ 3.1.1.47) — фермент, катализирующий химическую реакцию
- 1-алкил-2-ацетил-sn-глицеро-3-фосфохолин + H2O
 1-алкил-sn-глицеро-3-фосфохолин + ацетат
1-алкил-sn-глицеро-3-фосфохолин + ацетат









