Кислородсодержащие соединения серы
Оксид серы (I)
Основная статья: Оксид серы (I)
Оксид серы (I) — S2О — бесцветный газ, неустойчивый при комнатной температуре.
Монооксид серы
Основная статья: Оксид серы (II)
Монооксид серы — SO — бесцветный газ с резким, неприятным запахом. Неустойчив, бурно реагирует с кислородом, превращаясь в диоксид серы, что обуславливает редкость его нахождения в природе.
Диоксид серы. Сернистая кислота
Основная статья: Оксид серы (IV)
Оксид серы (IV) — SO2 (диоксид серы, сернистый газ) представляет собой бесцветный газ с резким характерным запахом. Образуется при сгорании серы:
S + O2 = SO2
Раствор сернистого газа в воде (до 40 объёмов SO2 на 1 объём воды) — неустойчивая двухосновная сернистая кислота, которая существует только в растворе:
SO2 + H2O = H2SO3 (реакция обратима)
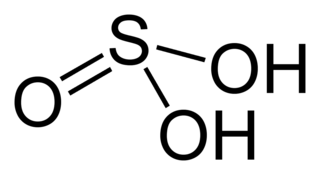
Основная статья: Сернистая кислота
Сернистая кислота является слабой кислотой, в водных растворах она диссоциирует ступенчато с образованием гидросульфит- и сульфит-ионов
H2SO3 = H+ + HSO3-
HSO3 = H+ + SO32-
Сернистая кислота проявляет химические свойства, общие для кислот: взаимодействует с основными оксидами, основаниями, вступает в реакцию обмена с солями других кислот.
Триоксид серы
Основная статья: Триоксид серы(VI)
Оксид серы (VI) — SO3 — высший оксид серы.
Получают, окисляя оксид серы (IV) в присутствии катализатора при температуре около 5000 C. При обычных условиях оксид серы(VI) — бесцветная едкая жидкость, которая при температуре ниже 170 C превращается в белое кристаллическое вещество. Это типичный кислотный оксид, который взаимодействует с водой с образованием серной кислоты.
Серная кислота
Основная статья: Серная кислота
Физические свойства
Тяжелая (плотность 1,83г/см3), бесцветная маслянистая жидкость без запаха. Смешивается с водой в любых соотношениях. Разогревание смеси при растворении серной кислоты в воде может сопровождаться её разбрызгиванием. Нельзя приливать воду к кислоте,следует при непрерывном перемешивании раствора вливать кислоту в воду.
Химические свойства
В разбавленных растворах серная кислота является сильным электролитом.
Разбавленная серная кислота проявляет все характерные свойства кислот: взаимодействует с металлами, стоящими в ряду активности до водорода, с основными оксидами, с основаниями и солями. При этом образуются соли: средние — сульфаты, кислые — гидросульфаты. Большинство сульфатов и гидросульфатов хорошо растворимы в воде, многие из них образуют кристаллогидраты. Некоторые кристаллогидраты называют купоросами.
Для качественного обнаружения серной кислоты и её солей в водных растворах используются растворимые соли бария. В результате реакции образуется белый осадок сульфата бария.
Концентрированная серная кислота является более сильным окислителем, чем разбавленная. При взаимодействии концентрированной серной кислоты с металлами водород не выделяется. С металлами, стоящими в ряду активности после водорода (кроме золота и платины), реакция протекает с образованием оксида серы (IV).
С металлами,стоящими в ряду активности до водорода, концентрированная серная кислота восстанавливается до оксида серы(IV), серы или сероводорода в зависимости от активности металла и условий протекания реакции.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994