Кисло́ты — химические соединения, способные отдавать катион водорода, либо соединения, способные принимать электронную пару с образованием ковалентной связи.
Гомеоста́з — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Стремление системы воспроизводить себя, восстанавливать утраченное равновесие, преодолевать сопротивление внешней среды.

Водоро́дный показа́тель (pH [пэ-аш] ← лат. pondus Hydrogenii «вес водорода») — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. Противоположна по знаку и равна по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]):
 .
.
Ио́нное произведе́ние воды́ (KW) — произведение концентраций ионов водорода Н+ и гидроксид-ионов OH− в воде или в водных растворах, константа автопротолиза воды.

Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д. Чем больше значение Ka, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная.

Диуре́тики — средства различной химической структуры, тормозящие в канальцах почек реабсорбцию воды и солей и увеличивающие их выведение с мочой; повышающие скорость образования мочи и, таким образом, уменьшающие содержание жидкости в тканях и серозных полостях. Диуретики, снижающие реабсорбцию натрия, повышающие натрийурез, называют салуретиками.

Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации:

Бу́ферные раство́ры — растворы с определённой устойчивой концентрацией водородных ионов, рН которых мало изменится при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании.
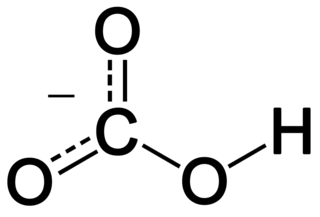
Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3. Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.

Ацидоз — смещение кислотно-щелочного баланса организма в сторону увеличения кислотности.

Ено́лы (также алкенолы) — α-гидроксиалкены (виниловые спирты), соединения общей формулы R1R2C=CR3OH.
Стеклянные электроды — тип ионоселективных электродов, сделанных из легированных стеклянных мембран, которые чувствительны к специфическим ионам, используемые для определения концентрации ионов в растворе. Важная часть приборов химического анализа и физико-химических исследований. В современной практике широко применяются мембранные ионоселективные электроды, являющиеся частью гальванического элемента. Электрический потенциал электродной системы в растворе чувствителен к изменению содержания определённого вида ионов, что выражается и в зависимости электродвижущей силы (ЭДС) гальванического элемента от концентрации этих ионов.

Кислотность почвы — способность почвы проявлять свойства кислот.

Париета́льная кле́тка, также обкла́дочная кле́тка, гландулоци́т париета́льный — клетка желудка, секретирующая соляную кислоту и внутренний фактор Касла.

Водоро́дно-ка́лиевая аденозинтрифосфата́за (другие названия: Н+/К+-АТФа́за, Н+/K+-аденозинтрифосфата́за, ка́лий-водоро́дная аденозинтрифосфата́за) — фермент класса транслоказ (КФ 7.2.2.19 Архивная копия от 19 сентября 2003 на Wayback Machine). В гастроэнтерологии и фармацевтике, ориентированной на органы пищеварения, вместо водородно-калиевая аденозинтрифосфатаза обычно используют синонимы: прото́нная по́мпа, прото́нный насо́с, прото́новый насо́с, или прото́новая по́мпа (особенно часто в словосочетаниях типа: «ингибитор протонного насоса», «ингибитор протонной помпы» и т. д.).
Тео́рии кисло́т и основа́ний — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Показа́тель — в большинстве случаев, обобщённая характеристика какого-либо объекта, процесса или его результата, понятия или их свойств, обычно, выраженная в числовой форме:
- В математике:
- Показатель степени
- Показатель числа по модулю
- В химии:
- Водородный показатель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность.
- Показатель константы кислотности, pKa — мера силы кислоты.
- Показатель константы основности, pKb — мера силы основания.
- Показатель константы равновесия, pKp — отрицательный десятичный логарифм константы равновесия
 .
.
- В экономике:
- Финансовые показатели
- Экономические показатели
- Макроэкономические показатели
- В социологии:
- Топоним:
- Показатель — хутор в Веселовском районе Ростовской области.
Бу́ферные систе́мы кро́ви — физиологические системы и механизмы, обеспечивающие заданные параметры кислотно-основного равновесия в крови. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов.
Автопротолиз — гомофазный процесс самоионизации, обратимый процесс передачи протона от одной нейтральной молекулы жидкости к другой и образования в результате равного числа катионов и анионов.
Уравнение Гендерсона — Хассельбаха — связывает pH химического раствора слабой кислоты с числовым значением константы диссоциации кислоты Ka и отношением концентраций, кислоты и сопряженного с ней основания находятся в равновесии.












