Комплекс стимуляции анафазы

Ко́мплекс, стимули́рующий анафа́зу (англ. anaphase-promoting complex, APC), также называемый циклосома, представляет собой крупное белковое соединение, которому отводится решающая роль в активации анафазы митоза. Функционально комплекс стимуляции анафазы представляет собой убиквитинлигазу и катализирует реакции присоединения молекул убиквитина к различным целевым белкам, которые в итоге подвергаются протеолизу[2].
Строение
В структуре комплекса стимуляции анафазы выделяется порядка 11—13 субъединиц. Ядро комплекса составляют: субъединица куллина (Apc2) и RING-домен[англ.] (Apc11), к которому присоединяется убиквитин-конъюгирующий фермент[англ.] (E2). Функционирование комплекса регулируется за счёт присоединения активирующей субъединицы в нужный момент клеточного цикла. Два основных активатора — Cdc20 и Cdh1 — обеспечивают взаимодействие комплекса с целевыми белками[1].
Функции
Одной из ключевых мишеней комплекса стимуляции анафазы является белок секурин, разрушение которого приводит к высвобождению сепаразы — протеолитического фермента, обеспечивающего ликвидацию когезии сестринских хроматид. В завершении указанной цепочки реакций разделённые хроматиды расходятся к противоположным полюсам делящейся клетки. Второй ключевой мишенью комплекса стимуляции анафазы являются митотические циклины, деградация которых приводит к завершению митоза и цитокинеза[1]. И наконец, после окончания митотического деления на протяжении фазы G1 комплекс APC сдерживает активность циклин-зависимых киназ путём протеолитического разрушения S- и M-циклинов.
Регуляция
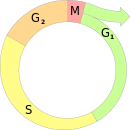
В основу регуляции активности комплекса APC заложен принцип отрицательной обратной связи. Взаимосвязь при этом прослеживается между активностью циклин-зависимых киназ (англ. Cdk) и активностью комплекса, стимулирующего анафазу (англ. APC). Начиная с анафазы митоза и до окончания фазы G1 в активном состоянии находится комплекс APC, который переводит в неактивное состояние циклин-зависимые киназы. К концу фазы G1, наоборот, активируются циклин-зависимые киназы, которые деактивируют комплекс APC и регулируют дальнейшее течение клеточного цикла вплоть до начала новой анафазы[3].
Установлено, что нарушение регуляции клеточного цикла в фибробластах человека при цитомегаловирусной инфекции связано с инактивацией комплекса APC и накоплением его субстратов[4].
Cdc20
Белок Cdc20 (англ. cell division cycle protein 20 — «белок клеточного цикла 20») активирует комплекс APC при переходе делящейся клетки из метафазы в анафазу. Происходит это следующим образом. На стадии метафазы циклин-киназный комплекс M-Cdk путём фосфорилирования трансформирует ядро комплекса APC. В результате указанного конформационного изменения повышается вероятность присоединения активатора Cdc20. В итоге, активированный комплекс APCCdc20 обретает убиквитинлигазную активность и убиквитинирует свои главные цели — секурин и митотические циклины[1].
Секурин (одна из главных мишеней APCCdc20) представляет собой ингибирующий белок, сдерживающий в неактивном состоянии фермент сепаразу. Вследствие реакции убиквитинирования секьюрин разрушается, а высвободившаяся при этом сепараза разрушает когезин. После деградации когезина, обеспечивающего сцепление сестринских хроматид, происходит разделение и расхождение хромосом к полюсам деления клетки[5].
Убиквитинирование и, как следствие, разрушение митотических циклинов (ещё одной важной мишени APCCdc20) запускает цепочку отрицательной обратной связи. Выглядит это следующим образом. Циклин-киназный комплекс M-Cdk активирует убиквитинлигазный комплекс APCCdc20, который целенаправленно разрушает митотические циклины, что ведёт к деградации циклин-киназного комплекса M-Cdk, т. е. цепочка реакций приводит к разрушению изначального активатора этой цепочки. Но, поскольку активность APCCdc20 зависит от комплекса M-Cdk, инактивация циклин-киназы M-Cdk приводит к инактивации APCCdc20. В итоге APCCdc20 деактивируется к концу митоза[1].
Cdh1
Во всех эукариотических клетках[~ 1], при переходе в фазу G1 возникает необходимость предотвращения повторной активации циклин-зависимых киназ, чтобы обеспечить стабильный рост клетки до вступления в следующий клеточный цикл. Сдерживание активности циклин-зависимых киназ на протяжении фазы G1 достигается как минимум тремя способами: снижением уровня экспрессии генов циклинов, активностью ингибиторов циклин-зависимых киназ и активностью комплекса APC, обеспечивающего протеолитическое разрушение S- и M-циклинов. В качестве активатора комплекса APC на протяжении фазы G1 выступает белок Cdh1[3].
Белок Cdh1 (англ. Cdc20-homologue 1 — «Cdc20-гомолог 1») активирует комплекс APC на заключительных этапах митоза и в начале фазы G1. При этом не требуется конформационного изменения комплекса APC, как в случае активации с участием Cdc20. Однако условиями образования активного комплекса APCCdh1 являются: деактивация циклин-зависимых киназ и высвобождение белка Cdc20 из комплекса APCCdc20. Оба данных условия достигаются к концу митоза, что и объясняет соответствующую по времени активацию комплекса APCCdh1. Свои функции APCCdh1 выполняет до наступления S-фазы клеточного цикла[3].
К окончанию фазы G1 возрастает концентрация G1/S-циклинов, которые не распознаются комплексом APCCdh1. Формирующиеся циклин-киназные комплексы G1/S-Cdk фосфорилируют Cdh1 и тем самым деактивируют комплекс APCCdh1, после чего комплекс APC пребывает в неактивном состоянии вплоть до анафазы митоза[3].
Примечания
Комментарии
Источники
- ↑ 1 2 3 4 5 Morgan D. O., 2007, p. 48.
- ↑ Morgan D. O., 2007, p. 46.
- ↑ 1 2 3 4 Morgan D. O., 2007, p. 49.
- ↑ Tran K., Mahr J. A., Choi J., Teodoro J. G., Green M. R., Spector D. H. Accumulation of substrates of the anaphase-promoting complex (APC) during human cytomegalovirus infection is associated with the phosphorylation of Cdh1 and the dissociation and relocalization of APC subunits. (англ.) // Journal of virology. — 2008. — Vol. 82, no. 1. — P. 529—537. — doi:10.1128/JVI.02010-07. — PMID 17942546.
- ↑ Alberts B. at al., 2008, p. 1087.
Литература
- Alberts B. at al. Molecular biology of the cell. — 5th edition. — Garland science, 2008. — P. 1087. — 1601 p. — ISBN 978-0-8153-4105.
- Morgan D. O. The cell cycle: principles of control. — New science press, 2007. — P. 46-49. — 297 p. — ISBN 978-0-9539181-2-6.