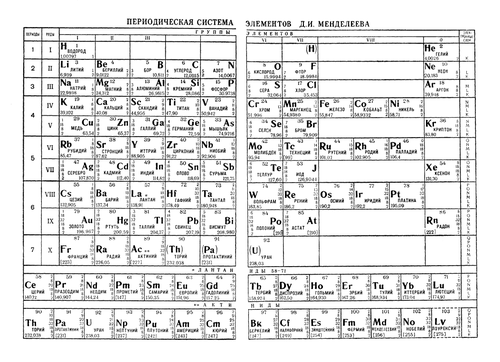
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.

Периоди́ческая систе́ма хими́ческих элеме́нтов — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Периодическая таблица была представлена независимо и почти одинаково двумя химиками в 1869 году: сначала русским Дмитрием Менделеевым, а через несколько месяцев немцем Лотаром Мейером и приведена к традиционному графическому виду в 1871 году. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.

Немета́ллы — химические элементы, как правило, не обладающие свойствами металлов. Занимают правый верхний угол Периодической системы элементов Менделеева и обычно отделены линией (лесенкой). Количество неметаллов составляет 22-23 элемента, в зависимости от классификации.
Нобе́лий — химический элемент 3-й группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 102. Относится к семейству актиноидов.
Лоуре́нсий — химический элемент 3-й группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 103.
Благоро́дные га́зы — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса, с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы и скорее всего будут близки к свойствам металлоидов, таких как астат (At) и теллур (Te).
Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом атомных ядер. Атомное ядро состоит из протонов, число которых равно атомному номеру элемента, и нейтронов, число которых может быть различным. Каждый химический элемент имеет своё латинское название и химический символ, состоящий из одной или пары латинских букв, регламентированные ИЮПАК и приводятся, в частности, в таблице Периодической системы элементов Менделеева.
Мейтне́рий — химический элемент с атомным номером 109. Принадлежит к 9-й группе периодической таблицы химических элементов, находится в седьмом периоде таблицы. В природе отсутствует, массовое число наиболее стабильного из известных изотопов равно 278(его атомная масса равна 278,156 а. е. м.). Обозначается символом Mt. Ранее был известен как унниленний (Une) или эка-иридий. Синтезирован искусственно.
Пери́од — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки, где в каждый период входят элементы с одинаковым количеством электронных оболочек.

Гру́ппа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.
Перехо́дные мета́ллы (перехо́дные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом:  . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на
. На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на  -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
-орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.

Халькоге́ны — химические элементы 16-й группы периодической таблицы химических элементов . В группу входят кислород O, сера S, селен Se, теллур Te, полоний Po и искусственно полученный радиоактивный ливерморий Lv. Типичная степень окисления −2, также для всех халькогенов кроме кислорода характерны степени оксиления +4 и +6. Бинарные соединения этих элементов с металлами носят общее название халькогенидов.

Подгру́ппа азо́та, или пниктоге́ны, также пникти́ды — химические элементы 15-й группы периодической таблицы химических элементов . В группу входят азот N, фосфор P, мышьяк As, сурьма Sb, висмут Bi и искусственно полученный радиоактивный московий Mc. Элементы главной подгруппы V группы имеют пять электронов на внешнем электронном уровне. В целом характеризуются как неметаллы. Способность к присоединению электронов выражена значительно слабее, по сравнению с халькогенами и галогенами. Все элементы подгруппы азота имеют электронную конфигурацию внешнего энергетического уровня атома ns²np³ и могут проявлять в соединениях степени окисления от −3 до +5. Вследствие относительно меньшей электроотрицательности связь с водородом менее полярна, чем связь с водородом халькогенов и галогенов. Водородные соединения этих элементов не отщепляют в водном растворе ионы водорода, иными словами, не обладают кислотными свойствами. Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл. Таким образом, в данной группе резко изменяются свойства составляющих её элементов: от типичного неметалла до типичного металла. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении её разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка. Редко используемое альтернативное название этой группы элементов — пниктогены, в переводе с греческого языка означает удушающий, что больше относилось к первому элементу группы — азоту, который, несмотря на безвредность, не поддерживает горения и дыхания. Однако данное название в целом хорошо характеризует данную группу элементов, так как большинство из них, как в виде простого вещества, так и в виде соединений очень ядовиты.

Альтернативные периодические таблицы являются табличным представлением химических элементов, которое значительно отличается от организации элементов в Периодической таблице Менделеева. В настоящее время различными авторами предложено множество вариантов, которые в основном нацелены на дидактическое преподнесение материала, так как не все корреляции между химическими элементами видны из стандартной Периодической системы.
Подгру́ппа углеро́да — химические элементы 14-й группы периодической таблицы химических элементов . В группу входят углерод С, кремний Si, германий Ge, олово Sn, свинец Pb и недавно открытый искусственный радиоактивный элемент флеровий Fl.
Подгру́ппа хро́ма — химические элементы 6-й группы периодической таблицы химических элементов. В группу входят хром Сr, молибден Mo, вольфрам W и сиборгий Sg. На внешнем энергетическом уровне у атомов хрома и молибдена находится один электрон, у вольфрама и сиборгия — два, поэтому характерным признаком данных элементов является металлический блеск, что и отличает эту побочную подгруппу от главной. Степень окисления в соединениях всех элементов подгруппы хрома равна +6, а также +5, +4, +3 и +2. По возрастанию порядкового номера элементов возрастает и температура плавления. Например, вольфрам — самый тугоплавкий металл, его температура плавления составляет 3390 °C. Элементы подгруппы достаточно устойчивы к внешним факторам. По физическим и химическим свойствам молибден и вольфрам сходны, но отличаются от хрома.
Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re. На основании электронной конфигурации атома к этой же группе относится и элемент борий Bh, искусственно синтезированный в 1976 г. группой Юрия Оганесяна из Объединённого института ядерных исследований в Дубне.
Подгру́ппа ска́ндия — химические элементы 3-й группы периодической таблицы химических элементов. Ввиду особенностей строения электронной конфигурации элементов этой группы точный состав её в разных источниках имеет различия. ИЮПАК не даёт строгих рекомендаций по спецификациям формата периодической таблицы. Поэтому по составу группы 3 имеются и часто используются несколько конвенций. Следующие d-элементы из переходных металлов всегда считаются членами группы 3:
Подгру́ппа вана́дия — химические элементы 5-й группы периодической таблицы химических элементов . В группу входят ванадий V, ниобий Nb и тантал Ta. На основании электронной конфигурации атома к этой же группе относится и элемент дубний Db, искусственно синтезированный в наукограде Дубне в 1970 г. группой Г. Н. Флёрова путём бомбардировки ядер 243Am ионами 22Ne и независимо в Беркли (США) в реакции 249Cf+15N→260Db+4n.
Блок периоди́ческой табли́цы — это совокупность химических элементов со сходным расположением валентных электронов в атоме. Сходство заключается в том, что валентные электроны с наивысшей энергией у них занимают орбиталь одного типа. Термин впервые появился в работах французского физика Шарля Жане. В один и тот же блок периодической таблицы входят её смежные группы. Названия блоков совпадает с названием характеристической орбитали, на которой располагаются валентные электроны. Эти названия блоков следующие:
- s-блок
- p-блок
- d-блок
- f-блок
- g-блок (гипотетический)