
Белки́ — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций определяет большое разнообразие свойств молекул белков. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс и другие комплексы.

Кле́точное ядро́ — окружённая двумя мембранами важная структура эукариотической клетки. В клетках прокариот ядра нет. В клетках эукариот обычно одно ядро, однако некоторые типы клеток, например, эритроциты млекопитающих, не имеют ядра, а другие содержат несколько ядер.

Цитоскеле́т — это клеточный каркас или скелет, находящийся в цитоплазме живой клетки. Он присутствует во всех клетках эукариот, причём в клетках прокариот обнаружены гомологи всех белков цитоскелета эукариот. Цитоскелет — динамичная, изменяющаяся структура, в функции которой входит поддержание и адаптация формы клетки ко внешним воздействиям, экзо- и эндоцитоз, обеспечение движения клетки как целого, активный внутриклеточный транспорт и клеточное деление.

Микрофиламенты — нити, состоящие из молекул глобулярного белка актина и присутствующие в цитоплазме всех эукариотических клеток. В мышечных клетках их также называют «тонкие филаменты». Под плазматической мембраной микрофиламенты образуют трёхмерную сеть; в цитоплазме формируют пучки из параллельно ориентированных нитей или трехмерную сеть. Имеют диаметр около 6—8 нм.
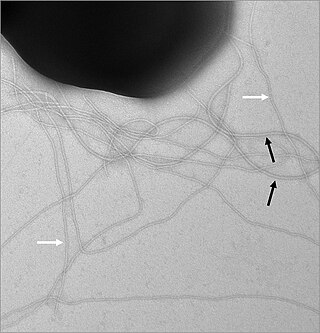
Жгу́тик — поверхностная структура, присутствующая у многих прокариотических и эукариотических клеток и служащая для их движения в жидкой среде или по поверхности твёрдых сред.
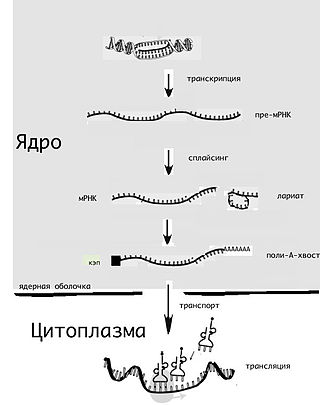
Ма́тричная рибонуклеи́новая кислота́ — РНК, содержащая информацию о первичной структуре белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется в ходе трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.

Виментин — белок промежуточных филаментов соединительных тканей и других тканей мезодермального происхождения. Промежуточные филаменты присутствуют во всех клетках животных и в бактериях, и наряду с микротрубочками и актином участвуют в построении цитоскелета. Несмотря на то, что большинство промежуточных филаментов — это устойчивые структуры, в фибробластах содержащие виментин филаменты является динамической структурой. Этот белок используется как маркер мезодермальных тканей.
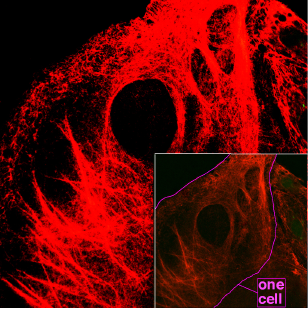
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога носорогов, перья и рамфотека клюва птиц и др.
Промежу́точные филаме́нты (ПФ) — нитевидные структуры из особых белков, один из трех основных компонентов цитоскелета клеток эукариот. Содержатся как в цитоплазме, так и в ядре большинства эукариотических клеток. Средний диаметр ПФ — около 10 нм, меньше, чем у микротрубочек и больше, чем у актиновых микрофиламентов. Название получили из-за того, что толщина цитоскелетных структур, состоящих из ПФ, занимала промежуточное положение между толщиной миозиновых филаментов и микротрубочек. В ядре известен только один тип ПФ — ламиновых, остальные типы — цитоплазматические.
Цитокератины — белки, из которых состоят внутриклеточные промежуточные филаменты цитоскелета эпителиальных клеток. Термин «цитокератин» был введен в конце 1970-х годов, когда был идентифицирован белок, из которого построены внутриклеточные промежуточные филаменты. В 2006 г. была введена новая номенклатура кератинов, согласно которой белки, ранее называвшиеся цитокератинами, рекомендовано именовать просто кератинами, так же как и сходные с ними кератины волос или ногтей. Тем не менее, в биомедицинской литературе имеется более 25 тыс. публикаций, в которых употребляется термин «цитокератин».

Полудесмосо́мы — клеточные контакты, расположенные на базальной стороне мембраны эпителиальной клетки и связывающие её с внеклеточным матриксом. Точнее, полудесмосомы связывают сеть промежуточных филаментов эпителиальных клеток с внеклеточным матриксом при помощи трансмембранных рецепторов. Электронная микроскопия показала, что структуры десмосом и полудесмосом очень похожи, однако десмосомы связывают не клетку и внеклеточный матрикс, а две соседние клетки. Основная функция полудесмосом заключается в прикреплении слоёв эпителия к базальной мембране.
Десмин — белок промежуточных филаментов, находящихся рядом с Z-линией в саркомерах. Он был получен в чистом виде в 1977 году, отвечающий за него ген был идентифицирован в 1989 году, а первая нокаутная мышь с отключённым геном десмина была создана в 1996 году. Десмин есть только у позвоночных. Тем не менее, гомологичные белки были найдены у многих организмов. Это — белок массой 52 кДа, выполняющий роль субъединицы в промежуточном филаменте скелетных, гладких и сердечных мышечных тканей.
Структурная функция белков заключается в том, что белки
- участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму);
- образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;входят в состав межклеточного вещества, во многом определяющего структуру тканей и форму тела животных.
Ламины, относящиеся к IV классу промежуточных филаментов — это фибриллярные белки, обеспечивающие структурную функцию и регуляцию транскрипции в ядре клеток. Ламины взаимодействуют с мембранными белками, чтобы образовать ядерную ламину на внутренней стороне ядерной оболочки. Они задействованы в дезинтеграции и образовании оболочки ядра в ходе митоза, а также в позиционировании ядерных пор.

Деление прокариотических клеток — процесс образования дочерних прокариотических клеток из материнской. Ключевыми событиями клеточного цикла как прокариот, так и эукариот являются репликация ДНК и деление клетки. Отличительной чертой деления прокариотических клеток является непосредственное участие реплицированной ДНК в процессе деления. В подавляющем большинстве случаев прокариотические клетки делятся с образованием двух одинаковых по размеру дочерних клеток, поэтому этот процесс ещё иногда называют бинарным делением. Так как чаще всего прокариотические клетки имеют клеточную стенку, бинарное деление сопровождается образованием септы — перегородки между дочерними клетками, которая затем расслаивается посередине. Процесс деления прокариотической клетки подробно изучен на примере Escherichia coli.

Цитоскеле́т прокарио́т — совокупное название для всех структурных филаментов прокариот. В прошлом считалось, что у прокариот цитоскелета нет, однако с начала 1990-х стали накапливаться данные о наличии у прокариот разнообразных филаментов. У прокариот не только имеются аналоги ключевых белков цитоскелета эукариот, но и белки, не имеющие аналогов у эукариот. Элементы цитоскелета играют важные роли в делении клеток, защите, поддержании формы и определении полярности у различных прокариот.

Синдекан 1 — мембранный белок, протеогликан семейства синдеканов, или трансмембранных гепарансульфатпротеогликанов. Всего описано 4 белка этого семейства. Продукт гена человека SDC1.
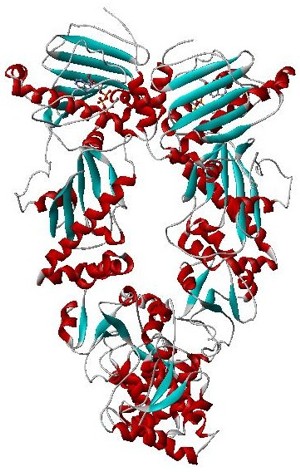
Hsp90, также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться, стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.

Бактериа́льная кле́тка обычно устроена наиболее просто по сравнению с клетками других живых организмов. Бактериальные клетки часто окружает капсула, которая служит защитой от внешней среды. Для многих свободноживущих бактерий характерно наличие жгутиков для передвижения, а также ворсинок.
LifeAct — это специфический краситель, который связывается и окрашивает филаменты актина (F-актин) в эукариотических клетках. Он представляет собой рекомбинантный белок состоящий из 17 аминокислотных остатков актин-связывающего белка Abp 140 генетически объединённых с флуоресцентным белком.













