Критическая точка (термодинамика)

Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — коннода, то есть изотерма равновесия жидкой и газовой фаз внутри двухфазной области.
Участок FA — перегретая жидкость.
Участок F′A — растянутая жидкость (p<0).
Участок AC — аналитическое продолжение изотермы, физически невозможен.
Участок CG — переохлаждённый пар.
Точка G — точка росы.
Участок правее точки G — нормальный газ.
Площади фигуры FAB и GCB равны.
Красная — критическая изотерма.
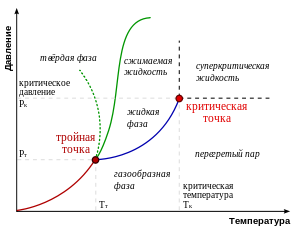
K — критическая точка.
Голубые — сверхкритические изотермы
Критическая точка фазового равновесия — точка на диаграмме состояния веществ, соответствующая критическому состоянию, то есть конечная точка кривой сосуществования фаз, в котором две (или более) фазы, находящиеся в термодинамическом равновесии, становятся тождественными по своим свойствам[6][7]. В частности, с приближением к критическому состоянию различия в плотности, составе и других свойствах сосуществующих фаз, а также теплота фазового перехода и межфазное поверхностное натяжение уменьшаются, а в критической точке равны нулю[7]. В окрестности критической точки наблюдаются критические явления.
В однокомпонентной системе в критической точке исчезает двухфазное состояние вещества и возникает новое состояние — критическое (критическая фаза[6]). На диаграмме состояния однокомпонентной системы существует лишь одна критическая точка равновесия жидкость — газ, характеризующаяся индивидуальными для каждого вещества значениями критических параметров: критической температуры фазового равновесия, критического давления, критического удельного объёма[6][7]. В литературе вместо критического удельного объёма иногда указывают критическую плотность вещества
- ,
где ρcrit — критическая плотность вещества, г/см³; M — молярная масса вещества, г/моль; Vcrit — критический удельный объём вещества, см³/моль.
При температуре выше критической газ невозможно перевести в жидкое состояние ни при каком давлении.
У смесей или растворов следует различать критическую точку равновесия жидкость — пар и критическую точку равновесия фаз различного состава, находящихся в одном агрегатном состоянии (жидкость — жидкость, газ — газ). В связи с этим критическая точка смесей (растворов) дополнительно характеризуется критической концентрацией компонентов. В результате увеличения числа параметров, определяющих состояние системы, у смесей имеется не одна критическая точка, а совокупность критических точек, образующих кривую критических точек[6] (критическую кривую[7][8]). Пример такой кривой приведён на внешнем изображении 1.
Физическое значение
В критической точке плотность жидкости и её насыщенного пара становятся равны, а поверхностное натяжение жидкости падает до нуля, поэтому исчезает граница раздела фаз жидкость-пар. Такое состояние называется сверхкритической жидкостью.
Для смеси веществ критическая температура не является постоянной величиной и может быть представлена пространственной кривой (зависящей от пропорции составляющих компонентов), крайними точками которой являются критические температуры чистых веществ — компонентов рассматриваемой смеси.
Критической точке на диаграмме состояния вещества соответствуют предельные точки на кривых равновесия фаз, в окрестностях точки фазовое равновесие нарушается, происходит потеря термодинамической устойчивости по плотности вещества. По одну сторону от критической точки вещество однородно (обычно при ), а по другую — разделяется на жидкость и пар.
В окрестностях точки наблюдаются критические явления: из-за роста характеристических размеров флуктуаций плотности резко усиливается рассеяние света при прохождении через вещество — при достижении размеров флуктуаций порядков сотен нанометров, то есть длин волн света, вещество становится непрозрачным — наблюдается его критическая опалесценция. Рост флуктуаций приводит также к усилению поглощения звука и росту его дисперсии, изменению характера броуновского движения, аномалиям вязкости, теплопроводности, замедлению установления теплового равновесия и т. п.





История
Впервые явление критического состояния вещества было обнаружено в 1822 году Шарлем Каньяром де Ла-Туром, а в 1860 году повторно открыто Д. И. Менделеевым. Систематические исследования начались с работ Томаса Эндрюса. Практически явление критической точки можно наблюдать при нагревании жидкости, частично заполняющей запаянную трубку. По мере нагрева мениск постепенно теряет свою кривизну, становясь всё более плоским, а при достижении критической температуры перестает быть различимым. Существование критических точек растворимости обнаружено (1876) В. Ф. Алексеевым[9].
| Вещество | |||
|---|---|---|---|
| Единицы | Кельвины | Атмосферы | см³/моль |
| Водород | 33,0 | 12,8 | 61,8 |
| Кислород | 154,8 | 50,1 | 74,4 |
| Ртуть | 1750 | 1500 | 44 |
| Этанол | 516,3 | 63,0 | 167 |
| Диоксид углерода | 304,2 | 72,9 | 94,0 |
| Вода | 647 | 218,3 | 56 |
| Азот | 126,25 | 33,5 | 90,1 |
| Аргон | 150,86 | 48,1 | |
| Бром | 588 | 102 | |
| Гелий | 5,19 | 2,24 | |
| Йод | 819 | 116 | |
| Криптон | 209,45 | 54,3 | |
| Ксенон | 289,73 | 58 | |
| Метан | 190,65 | 45,8 | |
| Мышьяк | 1673 | ||
| Неон | 44,4 | 27,2 | |
| Радон | 378 | ||
| Селен | 1766 | ||
| Сера | 1314 | ||
| Фосфор | 994 | ||
| Фтор | 144,3 | 51,5 | |
| Хлор | 416,95 | 76 |
Критические точки растворимости
Критические точки существуют не только для чистых веществ, но и, в некоторых случаях, для их смесей и определяют параметры потери устойчивости смеси (с разделом фаз) — раствор (одна фаза). С увеличением температуры взаимная растворимость ограниченно растворимых жидкостей в большинстве случаев возрастает (как, например, в системе вода — фенол). При достижении верхней критической точки растворимости на диаграмме состояния (именуемой в данном случае кривой расслоения[10], см. рисунок), то есть определенной температуры, называемой верхней критической температурой растворимости, жидкости полностью смешиваются друг с другом. (Для системы вода — фенол критическая температура составляет 68,8 °C. Выше этой температуры фенол и вода растворяются друг в друге в любых пропорциях). Реже встречаются системы, в которых с понижением температуры взаимная растворимость компонентов увеличивается, то есть системы с нижней критической температурой растворимости (нижней критической точкой растворимости, см. рисунок). К таким системам относится, например, смесь вода — триэтиламин (нижняя критическая температура 19,1 °C)[11].
Известны системы с двумя критическими точками растворимости — верхней и нижней; обычно в таких системах нижняя критическая точка находится под верхней, как, например, в системе вода — никотин. На диаграмме растворимости смеси бензол — сера нижняя критическая точка расположена над верхней[12][13] (см. рисунки). Зачастую кривая расслоения смеси не может проявиться полностью из-за кипения либо кристаллизации (см. внешнее изображение 2). На внешнем изображении 3 приведены примеры сложных фазовых диаграмм с верхней и нижней критическими точками расслоения. Внешние изображения 4 и 5 содержат дополнительные примеры критических кривых.
Фазовые переходы в критических точках растворимости, где взаимная растворимость компонентов становится неограниченной, представляют собой частные случаи фазовых переходов второго рода. Они не сопровождаются тепловыми эффектами и скачками удельного объёма[11].
Моноизотопный газ при критической температуре неограниченно сжимается до перекрытия электронных оболочек соседних атомов без роста давления.
Примечания
- ↑ Карапетьянц М. Х., Химическая термодинамика, 2013, с. 15.
- ↑ Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 385.
- ↑ Булидорова Г. В. и др., Физическая химия, 2012, с. 360.
- ↑ Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа, 1947, с. 696.
- ↑ Жариков В. А., Основы физической геохимии, 2005, с. 480.
- ↑ 1 2 3 4 Камилов И. К., Критическая точка, 2010.
- ↑ 1 2 3 4 Анисимов М. А., Критическая точка, 1990.
- ↑ Анисимов М. А., Критическая точка, 1973.
- ↑ Лукьянов А. Б., Физическая и коллоидная химия, 1988, с. 61.
- ↑ Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 383.
- ↑ 1 2 Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 384.
- ↑ Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 384—385.
- ↑ Акопян А. А., Химическая термодинамика, 1963, с. 425.
Литература
- Акопян А. А. Химическая термодинамика. — М.: Высшая школа, 1963. — 527 с.
- Анисимов М. А. Критическая точка // Большая советская энциклопедия. — М.: Советская энциклопедия, 1973. — Т. 13. — С. 453.
- Анисимов М. А. Критическая точка // Физическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 523—524.
- Аносов В. Я., Погодин С. А. Основные начала физико-химического анализа. — М.: Изд-во АН СССР, 1947. — 876 с.
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В.П. Физическая химия. — Казань: Изд-во Казан. нац. исслед. технол. ун-та, 2012. — 396 с. — ISBN 978-5-7882-1367-5.
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В.П. Физическая химия. Книга 1. Основы химической термодинамики. Фазовые равновесия. — М.: КДУ; Университетская книга, 2016. — 516 с. — ISBN 978-5-91304-600-0.
- Жариков В. А. Основы физической геохимии. — М.: Наука; Изд-во МГУ, 2005. — 656 с. — (Классический университетский учебник). — ISBN 5-211-04849-0, 5-02-035302-7.
- Камилов И. К. Критическая точка // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2010. — Т. 16. — С. 68.
- Карапетьянц М. Х. Химическая термодинамика. — М.: Либроком, 2013. — 584 с. — ISBN 978-5-397-03700-6.
- Лукьянов А. Б. Физическая и коллоидная химия. — 2-е изд., перераб. и доп. — М.: Химия, 1988. — 288 с. — ISBN 5-7245-0019-1.




























