Физи́ческая хи́мия — раздел химии, наука об общих законах строения, структуры и превращения химических веществ. Исследует химические явления с помощью теоретических и экспериментальных методов физики. Наиболее обширный раздел химии.
Элемента́рный электри́ческий заря́д — фундаментальная физическая постоянная, минимальная порция (квант) электрического заряда, наблюдающегося в природе у свободных долгоживущих частиц. Согласно изменениям определений основных единиц СИ равен точно 1,602 176 634⋅10−19 Кл в Международной системе единиц (СИ). Тесно связан с постоянной тонкой структуры, описывающей электромагнитное взаимодействие.
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
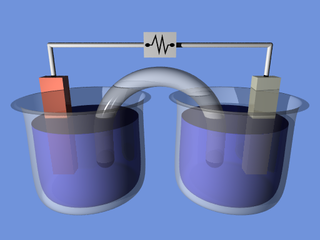
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электрохимические методы анализа — группа методов количественного химического анализа, основанные на использовании электролиза.
Электрохимический эквивалент — масса вещества, которая должна выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества заряда. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.

Полярография — электрохимический метод качественного и количественного анализа и изучения кинетики химических процессов, предложенный в 1922 году чешским химиком Я. Гейровским. За разработку этого метода ему была присуждена в 1959 году Нобелевской премия по химии.
Уравне́ние Пуассо́на — эллиптическое дифференциальное уравнение в частных производных, которое описывает
- электростатическое поле,
- гравитационное поле,
- стационарное поле температуры,
- поле давления,
- поле потенциала скорости в гидродинамике.
Орбитрэ́п или орбитрап — специальная ионная ловушка, использующая принципиально новую концепцию масс-анализа, реализованную только в 2000-х годах.
Электрохимический потенциал — химический потенциал электрически заряженных частиц и квазичастиц в электрическом поле. Специальный термин понадобился по причине принятого в литературе условного разбиения электрохимического потенциала на неэлектрическую и электрическую части. С теоретической точки зрения такое разделение носит чисто формальный характер, поскольку носителями заряда служат те же самые формульные единицы, с которыми соотносят обычный химический потенциал, и поэтому нет способа раздельного определения его химической и электрической составляющих. Практически же разделение электрохимического потенциала на две части иногда оказывается хорошим приближением, ибо в природе существуют частицы, для которых вследствие малости их массы вклад неэлектрической части в электрохимический потенциал пренебрежимо мал по сравнению со вкладом электрической составляющей.
Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества теоретически необходимого Qt заряда к фактически пропущенному Qf через электролит для осуществления фактически наблюдаемого массопереноса mf.


Мембра́нный потенциа́л, также трансмембра́нный потенциал или напряже́ние мембра́ны, иногда потенциа́л Не́рнста — разница в электрическом потенциале, возникающая между зарядами внутренней и внешней стороны полупроницаемой мембраны. Что касается внутренней части клетки, то типичные значения мембранного потенциала для неё располагаются в диапазоне от −40 мВ до −80 мВ.

Электрохими́ческий градие́нт, или градиéнт электрохимического потенциáла, — совокупность градиента концентрации и мембранного потенциала, которая определяет направление движения ионов через мембрану. Состоит из двух составляющих: химического градиента, или разницы в концентрациях растворённого вещества по обе стороны мембраны, и электрического градиента, или разницы зарядов, расположенных на противоположных сторонах мембраны. Градиент возникает вследствие неодинаковой концентрации ионов на противоположных сторонах водопроницаемой мембраны. Ионы двигаются через мембрану из области, имеющую более высокую концентрацию в область с более низкой концентрацией путём простой диффузии. Также ионы несут электрический заряд, который формирует электрический потенциал на мембране. Если существует неравномерное распределение зарядов по обе стороны мембраны, то разница в электрическом потенциале порождает силу, которая приводит к ионной диффузии, пока заряды по обе стороны не будут сбалансированы.

Перч Карлович Агасян — советский и российский электрохимик, педагог, доктор химических наук, профессор кафедры аналитической химии химического факультета Московского государственного университета им. М. В. Ломоносова.

Диэлектри́ческая спектроскопи́я является частью импеда́нсной спектроскопии — раздел спектроскопии, изучающей диэлектрические свойства среды в зависимости от частоты.