Кутиназа
| Кутиназа | |
|---|---|
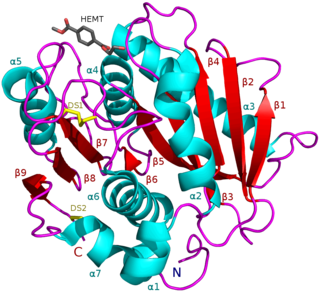
![Структура кутиназы Fusarium solani. PDB 1cex[1].](https://upload.wikimedia.org/wikipedia/commons/thumb/e/e9/PDB_1cex_EBI.jpg/274px-PDB_1cex_EBI.jpg) Структура кутиназы Fusarium solani. PDB 1cex[1]. | |
| Идентификаторы | |
| Шифр КФ | 3.1.1.74 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| Кутиназа | |
|---|---|
| Идентификаторы | |
| Символ | Cutinase |
| Pfam | PF01083 |
| PROSITE | PDOC00140 |
| SCOP | 1cex |
| SUPERFAMILY | 1cex |
| OPM superfamily | 127 |
| OPM protein | 1oxm |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Кутиназа (Шифр КФ 3.1.1.74) — фермент, катализирующий химическую реакцию:
- Кутин + H2O Кутиновые мономеры
Таким образом, двумя субстратами этого фермента являются кутин и H2O, тогда как его продуктом является мономер кутина.
Этот фермент принадлежит к семейству гидролаз, особенно тех, которые действуют на связи сложных эфиров карбоновых кислот. Систематическое название этого класса ферментов — кутингидролаза .
Надземные органы растений защищены кутикулой, состоящей из нерастворимого полимерного структурного соединения кутина, который представляет собой сложный полиэфир, состоящий из гидрокси- и гидроксиэпоксижирных кислот[2]. Патогенные грибы растений продуцируют внеклеточные ферменты деградации[3] которые играют важную роль в патогенезе. В их состав входит кутиназа, которая гидролизует кутин, способствуя проникновению грибка через кутикулу. Ингибирование фермента может предотвратить грибковую инфекцию через неповреждённую кутикулу. Мономеры кутина, высвобождаемые из кутикулы небольшими количествами кутиназы на поверхности спор грибов, могут значительно увеличивать количество кутиназы, секретируемой спорами, механизм чего пока неизвестен[2][3].
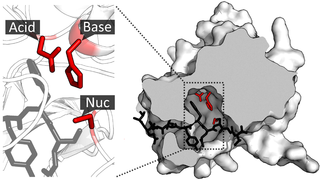
Кутиназа представляет собой серинэстеразу, содержащую классическую триаду сериновых гидролаз Ser, His, Asp[2]. Белок принадлежит к альфа-бета-классу с центральным бета-слоем из 5 параллельных нитей, покрытых 5 спиралями с каждой стороны листа. Щель активного сайта частично покрыта двумя тонкими мостиками, образованными боковыми цепями аминокислот, в отличие от гидрофобной крышки, которой обладают другие липазы[4]. Белок также содержит 2 дисульфидных мостика, которые необходимы для активности, их расщепление приводит к полной потере ферментативной активности[2]. Два кутиназоподобных белка (MtCY39.35 и MtCY339.08c) были обнаружены в геноме бактерий Mycobacterium tuberculosis .
Примечания
- ↑ Longhi S, Czjzek M, Lamzin V, Nicolas A, Cambillau C (May 1997). "Atomic resolution (1.0 A) crystal structure of Fusarium solani cutinase: stereochemical analysis". J. Mol. Biol. 268 (4): 779—99. doi:10.1006/jmbi.1997.1000. PMID 9175860.
- ↑ 1 2 3 4 "Structure of cutinase gene, cDNA, and the derived amino acid sequence from phytopathogenic fungi". Biochemistry. 26 (24): 7883—7892. 1987. doi:10.1021/bi00398a052.
- ↑ 1 2 "Cloning and analysis of CUT1, a cutinase gene from Magnaporthe grisea". Mol. Gen. Genet. 232 (2): 174—182. 1992. doi:10.1007/BF00279994. PMID 1557023.
- ↑ "Fusarium solani cutinase is a lipolytic enzyme with a catalytic serine accessible to solvent". Nature. 356 (6370): 615—618. 1992. doi:10.1038/356615a0. PMID 1560844.
- "Lipases in autolysed cultures of filamentous fungi". Lett. Appl. Microbiol. 25 (2): 127—30. 1997. doi:10.1046/j.1472-765X.1997.00187.x. PMID 9281862.
- "Hydrolysis of plant cuticle by plant pathogens. Purification, amino acid composition, and molecular weight of two isozymes of cutinase and a nonspecific esterase from Fusarium solani f. pisi". Biochemistry. 14 (13): 2824—31. 1975. doi:10.1021/bi00684a006. PMID 1156575.
- "Hydrolysis of plant cuticle by plant pathogens. Properties of cutinase I, cutinase II, and a nonspecific esterase isolated from Fusarium solani pisi". Biochemistry. 14 (13): 2832—40. 1975. doi:10.1021/bi00684a007. PMID 239740.