Лактоферрин
| Лактоферрин | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | neutrophil lactoferrinLTFlactoferroxinepididymis luminal protein 110talalactoferringrowth-inhibiting protein 12lactotransferrinkaliocin-1lactoferrin | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Лактоферрин — полифункциональный белок из семейства трансферринов. Лактоферрин является глобулярным гликопротеином с молекулярной массой около 80 кДа и широко представлен в различных секреторных жидкостях, таких как молоко, слюна, слёзы, секреты носовых желез.
Лактоферрин является одним из компонентов иммунной системы организма, принимает участие в системе неспецифического гуморального иммунитета, регулирует функции иммунокомпетентных клеток и является белком острой фазы воспаления.
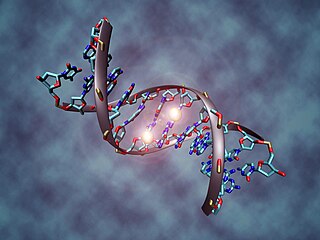
Белок взаимодействует с ДНК и РНК, полисахаридами, гепарином, причем некоторые из своих биологических функций лактоферрин проявляет в виде комплексов с этими лигандами.
Строение и физико-химические свойства
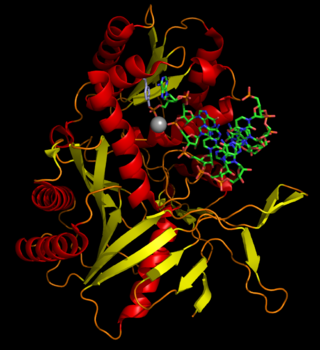
Строение молекулы лактоферрина
Лактоферрин принадлежит к семейству белков-трансферринов, осуществляющих перенос железа в клетки и контролирующих уровень свободного железа в крови и во внешних секретах. Лактоферрин представлен в молоке человека и других млекопитающих.[1]
Было показано, что помимо молока лактоферрин содержится в плазме крови, нейтрофилах и является одним из основных белков практически всех экзокринных секретов млекопитающих, таких как слюна, желчь, слёзы, секрет поджелудочной железы[2].
Концентрация лактоферрина в молоке изменяется от 7 мг/мл в молозиве до 1 мг/мл в зрелом молоке.
Согласно данным рентгеноструктурного анализа белок образован одной полипептидной цепью, которая содержит 692 аминокислотных остатка и образует два гомологичных глобулярных домена, называемых N- и С-долями (N-доля, остатки 1–333; C-доля, остатки 345–692), концы которых соединены короткой α-спиралью[3][4].
Каждая доля состоит из двух доменов N1, N2 и C1, C2 и содержит один железосвязывающий сайт и один сайт гликозилирования. Степень гликозилирования белка может быть различной, именно поэтому молекулярная масса белка по разным данным составляет от 76 до 80 кДа. Было показано, что устойчивость лактоферрина к деградации протеазами или при низких значениях рН обусловлена высокой степенью гликозилирования белка[5].
Лактоферрин относят к щелочным белкам, его изоэлектрическая точка составляет 8.7. Белок существует в двух формах – железонасыщенной (холо-ЛФ) и железоненасыщенной (апо-ЛФ), их третичные структуры различны: для апо-ЛФ характерна “открытая” конформация N-доли и “закрытая” конформация С-доли, а для холо-ЛФ характерна закрытая конформация обеих долей[6].
Каждая молекула белка может обратимо связывать два иона трехвалентного железа или ионы цинка, меди и других металлов[7].
Центры связывания локализованы в каждой из двух белковых глобул, составляющих молекулу лактоферрина. В каждой доле атом железа скоординирован с шестью лигандами, четыре из которых предоставлены цепью полипептида (два остатка тирозина, один остаток гистидина и один остаток аспарагиновой кислоты), а оставшиеся две связи железо образует с ионом карбоната или бикарбоната.
Лактоферрин образует с железом комплекс красноватого цвета, его сродство к железу в 300 раз выше, чем сродство трансферрина[8].
Кроме того, показано, что в слабокислой среде сродство белка к железу повышается, что облегчает переход металла с трансферрина на лактоферрин при воспалении, когда рН тканей снижается за счет молочной и других кислот[9].
Степень насыщения железом лактоферрина женского молока составляет по оценкам разных авторов от 10 до 30 %. Показано, что белок участвует не только в транспорте ионов железа, цинка и меди, но и в регуляции их всасывания[10].
Наличие непрочно связанных ионов цинка и меди не влияет на железосвязывающую функцию лактоферрина, и фактически даже усиливает её.
Полимерные формы
Как в плазме крови, так и в секреторных жидкостях лактоферрин может существовать в виде различных полимерных форм от мономера до тетрамера. Показано, что белок обнаруживает резко выраженную тенденцию к полимеризации in vitro и in vivo, и при высоких концентрациях преобладают полимерные формы лактоферрина.[9]
Кроме того, рядом авторов было обнаружено, что доминирующей формой лактоферрина в физиологических условиях является тетрамер; соотношение мономер : тетрамер при концентрации белка 10−5 М составляет 1 : 4.[11][12][13]
Существует предположение, что олигомерное состояние лактоферрина определяется концентрацией данного белка в среде, кроме того, полимеризация лактоферрина строго зависит от присутствия ионов Ca2+. В присутствии ионов кальция и при концентрации белка менее 10−10-10−11 M наблюдали преобладание мономерной формы белка. При концентрациях лактоферрина более 10−9-10−10 M происходил переход в тетрамерную форму[14][11].
Титр лактоферрина в крови соответствует величине именно этой “переходной концентрации” и, таким образом, лактоферрин в крови должен быть представлен как в виде мономера, так и тетрамера.
Также было показано, что ряд функциональных свойств лактоферрина определяется олигомерным состоянием молекулы белка. Так, лактоферрин в виде мономера способен к прочному связыванию с ДНК и регуляции процессов гранулопоэза, а тетрамерная форма не связывает ДНК. Есть все основания полагать, что в организации олигомерного состояния белка участвуют слабые взаимодействия — преимущественно гидрофобные и электростатические контакты боковых групп остатков аминокислот молекулы лактоферрина и, возможно, гликозидных остатков белка.
Биологические функции
Лактоферрин относят к системе врожденного иммунитета, существуют данные о том, что лактоферрин опосредованно вовлечен в процессы клеточного иммунитета. Главные биологические функции белка — это связывание и транспорт ионов железа, но кроме этого лактоферрин обладает антибактериальной, антивирусной, антипаразитарной, различными каталитическими активностями, а также противораковым, антиаллергическим, иммуномодулирующим действиями и радиопротективными свойствами[].
Антибактериальная активность
Наиболее изученным является механизм антибактериальной активности лактоферрина. Антибактериальные свойства белка обусловлены способностью лактоферрина связывать железо и тем самым лишать бактериальную микрофлору необходимого для её роста и жизнедеятельности микроэлемента[15]. Бактерицидные свойства белка также обусловлены наличием специфических лактоферриновых рецепторов на клеточной поверхности микроорганизмов. Показано, что лактоферрин связывает липополисахариды (ЛПС) бактериальных стенок, а входящая в состав белка окисленная форма железа инициирует их перекисное окисление. Это приводит к изменению мембранной проницаемости и последующему лизису клеток[15].
Все вышеперечисленные механизмы антибактериального действия лактоферрина напрямую зависят от железосвязывающих свойств белка. Вместе с тем в основе антиинфекционной активности лактоферрина могут лежать и другие механизмы, не зависящие от способности белка связывать ионы железа, например стимулирующее действие лактоферрина на фагоцитоз и влияние на активность комплемента[16].
Однако наиболее изученным механизмом антибактериального действия белка, не зависящим от его железосвязывающей способности, является специфическое взаимодействие лактоферрина с наружной бактериальной мембраной, которое приводит к гибели клеток бактерий[17].
Было показано, что белок разрушает бактериальную мембрану и даже проникает внутрь клетки. За специфическое связывание с бактериальной стенкой ответственен лактоферрицин — пептид, расположенный на N-конце молекулы лактоферрина и получаемый in vitro протеолитическим расщеплением белка трипсином[18][19].
Антивирусная активность
Показано, что лактоферрин обладает антивирусной активностью против широкого спектра вирусов человека и животных с ДНК и РНК геномами[20].
Лактоферрин связывает различные антигены вирусной природы преимущественно в условиях in vitro. На данный момент показано действие белка против вирусов простого герпеса 1 и 2,[21][22] цитомегаловируса,[23] ВИЧ,[22][24] вируса гепатита C,[25]<[26] хантавирусов, ротавирусов, полиовирусов первого типа,[19] аденовирусов,[27] респираторного синцитиального вируса, мышиного вируса лейкоза Френда[19], COVID-19.[28]
Наиболее изученным механизмом антивирусной активности лактоферрина является предотвращение попадания вирусных частиц в клетки-мишени. Многие вирусы имеют тенденцию связывать гепаринсульфат-гликозоаминогликаны и липопротеины мембран эукариотических клеток. После первоначального контакта с клеткой вирусная частица взаимодействует со специфическими вирусными рецепторами и проникает в клетку.[26]
Лактоферрин связывает гепарансульфат-гликозоаминогликаны и липопротеины на поверхности клеток, препятствуя тем самым связыванию с ними вирусных частиц и дальнейшему проникновению вируса в клетку. Интересно, что лактоферрицин, который обеспечивает основные антимикробные свойства лактоферрина, практически не проявляет антивирусной активности, кроме того, апо-ЛФ в большинстве случаев показывает гораздо большее антивирусное действие, чем металлонасыщенный лактоферрин.[20]
Помимо взаимодействия с клеточными рецепторами, лактоферрин напрямую связывает вирусные частицы и препятствует их проникновению в клетки. Это подтверждается наличием антивирусного действия белка против ротавирусов,[19] для которых клеточными рецепторами являются углеводные остатки, отличающиеся по составу от гликозаминогликанов, было показано взаимодействие лактоферрина с белками оболочки вируса гепатита.[26] Последним моментом в развитии антивирусной активности белка является ингибирование вирусной репликации уже после попадания вируса в клетку.[19][24] Такое непрямое противовирусное влияние осуществляется за счет регуляции синтеза натуральных киллеров, гранулоцитов и макрофагов -– клеток, которые играют решающую роль на ранних стадиях развития вирусной инфекции. Методами ПЦР в реальном времени и при помощи ДНК-микрочипов показано повышение экспрессии гена лактоферрина при тяжёлом остром респираторном синдроме (SARS).[29]
Антигрибковая активность
Показано, что лактоферрин и лактоферрицин ингибируют in vitro рост Trichophyton mentagrophytes, который вызывает ряд кожных заболеваний, например, стригущий лишай.[30] Лактоферрин обладает активностью против Candida albicans—симбионтов, образующих колонии в слизистой оболочке ротовой полости здоровых людей.[31][32] Тем не менее, этот вид является основным грибковым патогеном у людей с оппортунистическими инфекциями ротовой полости и организма в целом, а также у иммунодефицитных больных. Долгое время в качестве основного антигрибкового препарата против Candida albicans, использовали флюконазол, что привело к появлению штаммов, устойчивых к воздействию этого лекарства. Было показано, что лактоферрин в комплексе с флюконазолом обладает антигрибковой активностью против флюконазол-устойчивых штаммов Candida albicans, также других видов Candida: C. glabrata, C. krusei, C. parapsilosis и C. tropicalis.[31] Антигрибковую активность наблюдают только в случае последовательной инкубации клеток Candida с лактоферрином, а потом с флюконазолом, но не наоборот. Лактоферрицин обладает антигрибковой активностью, превосходящей активность самого лактоферрина, в составе лактоферрицина изучали два пептида, содержащие 1-11 и 17-26 аминокислотные остатки лактоферрина. Синтетически синтезированный пептид 1-11 обладает гораздо большей активностью против Candida albicans, чем нативный ЛФ.[31] Кроме того, показано, что пептид, содержащий 4-11 аминокислотные остатки, не вызывает гибели клеток Candida, что указывает на важность 1-4 аминокислот белка в проявления антигрибковой активности.[33] Исследования синтетического пептида 17-26 показали, что он стимулирует образование гидроксильных радикалов мышиными нейтрофилами и в комбинации с антигрибковым препаратом амфотерицином В защищает животных от летальных для них инфекций Candida albicans и Aspergillus fumigatus в гораздо большей степени, чем амфотерицин В один, причем in vitro антигрибковая активность пептида была в 10 раз ниже, чем активность амфотерицина В.[34]
Оральное введение лактоферрина через питьевую воду мышам с ослабленным иммунитетом и симптомами стоматита приводило к значительному уменьшению числа Candida albicans в ротовой полости и размеров повреждения языка.[35] Показано, что оральное введение лактоферрина уменьшает количество патогенных организмов в тканях, близких к желудочно-кишечному тракту у нескольких моделей инфицированных животных. Более того, ВИЧ-инфицированные больные с Candida albicans, устойчивые к антигрибковым препаратам, полностью избавлялись от грибковой инфекции после введения смеси, содержащей лактоферрин, лизоцим и интроаконазол.[36]
В отличие от антивирусного и антибактериального действия лактоферрина, очень мало известно о противогрибковом механизме действия белка. Показано, что антигрибковая активность лактоферрина обеспечивается разрушением клеточной стенки и связыванием белка с плазматической мембраной C. albicans. Действие лактоферрина на C. albicans in vitro приводит к изменению мембранного потенциала и закислению цитоплазмы клеток Candida, что говорит о прямом или косвенном взаимодействии лактоферрина с плазматической мембраной.[32]
Поскольку лактоферрин позволяет минимизировать концентрации лекарств, при которых происходит эффективное лечение грибковых инфекций, возможно его использование совместно с противогрибковыми препаратами в терапии заболеваний, вызываемых штаммами с лекарственной устойчивостью. Синергическое действие лактоферрина с антибиотиками, антигрибковыми и антибактериальными препаратами против патогенных микроорганизмов может быть очень эффективным. Кроме того, использование лактоферрина, который является одним из факторов неспецифической защиты в слюне, позволяет уменьшить распространение флюконазол-устойчивых видов Candida среди людей с ослабленной иммунной системой, в частности среди больных СПИДом.[37]
Взаимодействие с нуклеиновыми кислотами
Взаимодействие белков c ДНК является объектом многочисленных исследований, направленных на рассмотрение механизмов, контролирующих экспрессию генов.[11][38] Одним из важных свойств лактоферрина считают его способность связывать нуклеиновые кислоты. Обнаружено, что фракция белка, выделенного из молока, содержит 3.3 % РНК,[11] кроме того, при взаимодействии с одноцепочечной и двуцепочечной ДНК белок предпочтительнее связывает двуцепочечную ДНК. Взаимодействие лактоферрина с ДНК частично ингибировалось добавлением антител к ДНК, полученных из плазмы крови больных системной красной волчанкой.
Способность лактоферрина связывать ДНК активно используют для выделения и очистки белка с помощью аффинной хроматографии на колонках с иммобилизованными ДНК-содержащими сорбентами. Была предложена методика выделения лактоферрина из молочной плазмы на агарозе с иммобилизованной одноцепочечной ДНК.[39] При выделении белка из мочи новорожденных на этом сорбенте было обнаружено, что при прохождении через желудочно-кишечный тракт кроме неповрежденного лактоферрина (78 кДа) образуются два фрагмента 51 и 39 кДа, которые также связывают ДНК.[14]
Ферментативные активности лактоферрина
Лактоферрин гидролизует РНК и проявляет свойства пиримидин-специфических секреторных рибонуклеаз.
Сравнительный анализ данных рентгеноструктурного анализа лактоферрина и комплекса РНКазы А с аналогом субстрата 2’-5’ CpG в совокупности с анализом гомологии первичной последовательности этих двух белков показал наличие в молекуле лакоферрина структурных мотивов, подобных активному центру белков суперсемейства РНКазы А. Используя метод молекулярного моделирования, был проведен анализ топографии потенциального активного центра лактоферрина по аналогии с таковым для РНКазы А.[40] Кандидатами на роль ключевых аминокислотных остатков РНК-гидролизующего центра лактоферрина являются остатки аминокислот His-91, His-246 и Lys-237, которые находятся в оптимальной для катализа ориентации к другим ближайшим остаткам в возможном активном центре. Субстрат-связывающий участок образуют Asp-244, Lys-241 и Thr-90. Таким образом, потенциальный РНКазный центр лактоферрина расположен в междоменной области белка.
Способность лактоферрина гидролизовать РНК открывает ещё один аспект функций белка в организме, так как показано, что РНКазы молока путём разрушения РНК-генома ингибируют обратную транскрипцию ретровирусов, вызывающих рак молочной железы у мышей.[41] Было показано, что у женщин группы Парси в Западной Индии уровень РНКаз молока заметно ниже такового в остальных группах, а частота заболеваемости раком молочной железы превышает в три раза среднестатистическую заболеваемость.[42] Таким образом, можно предположить, что РНКазы молока и лактоферрин в частности играют важную роль в патогенезе заболеваний, вызываемых различными ретровирусами.
Также было показано, что изоформы лактоферрина обладают нуклеазными и фосфатазными активностями.[43] Гидролиз олигодезоксирибонуклеотидов лактоферрином протекал значительно медленнее, чем высокомолекулярных ДНК-субстратов. Исследуемая фракция белка не содержала ионов железа. Оптимальное значение pH реакционной смеси при гидролизе ДНК оценено близким 7.0-7.5. Эта величина значительно превышает значение рН оптимума других известных ДНКаз (5.0-5.5 у ДНКазы II крови человека). Кроме того по таким свойствам, как активация каталитической функции низкомолекулярными эффекторами и ионами металлов, лактоферрин существенно отличается от других ферментов с ДНКазной активностью.[44]
Была показана нуклеотид-гидролизующая активность препаратов лактоферрина.[43] Лактоферрину, помимо АТРазной активности, принадлежит активность, отщепляющая фосфатную группу от любых рибо- и дезоксирибонуклеозид- моно-, ди- и трифосфатов. Лактоферрин обладает свойствами неспецифической нуклеозид-5’-моно-, ди- и трифосфатфосфатазы, которую назвали нуклеотидфосфатазой.[43] При этом скорости дефосфорилирования нуклеотидов ниже, чем для классических АТРаз и нуклеозидаз, но сравнимы с таковыми или даже выше, чем для других широко распространенных ферментов, типа эндонуклеаз рестрикции.[45][46] Показано, что АТР-гидролизующая активность является железонезависимым свойством белка, а конформационные перестройки, вызванные координацией ионов железа, не влияют на АТРазный центр молекулы.[43]
Показано, что не разделенные на изоформы препараты лактоферрина разных доноров гидролизовали только 4,6-этилиден(G7)-п-нитрофенил-(G1)-a,D-мальтогептаозид, но не другие олигосахариды с иными связями между моносахаридными остатками (целлобиоза, лактоза, сахароза).[43] Препараты лактоферрина катализировали гидролиз мальтогептаозида с Km = (2.0±0.9) мМ. В целом эта величина Km для мальтогептаозида сопоставима или даже выше, чем таковые для α-амилазы (0.2-5 мМ) и каталитически активных антител молока и крови больных аутоиммунными заболеваниями (~ 10−4 М).[47][48]
Гены лактоферрина
Изучено 60 последовательностей генов лактоферрина 11 видов млекопитающих.[49]
У большинства видов, стоп-кодоном является TAA, и TGA у Mus musculus. Кодирующая часть из-за делеций, инсерций, а также мутаций стоп-кодонов значительно отличается и имеет длину от 2,055 до 2,190 пар нуклеотидов. Полиморфизм генов между видами существенно превышает внутривидовой полиморфизм лактоферрина. Обнаружены отличия в аминокислотных последовательностях: 8 у Homo sapiens, 6 у Mus musculus, 6 у Capra hircus, 10 у Bos taurus, и 20 в случае Sus scrofa. Такой разброс может свидетельствовать о функциональных отличиях лактоферринов разных видов.[49]
У человека ген лактоферрина LTF располагается на третьей хромосоме, в локусе 3q21-q23.
У быка кодирующая последовательность состоит из 17 экзонов и имеет длину около 34,5 тысяч пар нуклеотидов. Экзоны гена лактоферрина быка имеют сходный размер с экзонами других генов семейства трансферринов, в то время как размеры интронов внутри семейства отличаются. Эволюционное сходство размеров экзонов и их распределения в доменах белковой молекулы указывает на то, что ген лактоферрина произошёл путём дупликации. Последовательность промотороного участка гена лактоферрина быка не имеет некоторых участков связывания энхансеров транскрипции по сравнению с соответствующии последовательностями гена лактоферрина человека и мыши, что объясняет относительно низкую экспрессию гена лактоферрина у быка.[50]
Изучение полиморфизма генов, кодирующих лактоферрин, может способствовать выведению пород сельскохозяйственных животных, устойчивых к маститу[51] а также для создания лекарственных препаратов на основе белка. Институтом биологии гена РАН в 2007 году был создан рекомбинантный лактоферрин неолактоферрин.
Рецептор лактоферрина
Рецептор лактоферрина играет важную роль в процессе интернализации лактоферрина и облегчает абсорбцию ионов железа, связанных с лактоферрином. Методом количественной ПЦР было показано повышение экспрессии рецептора лактоферрина с возрастом в двенадцатиперстной кишке и снижение экспрессии в тощей кишке.[52]
См. также
Примечания
- ↑ Johansson, B. Isolation of an iron-containing red protein from human milk. (1960) Acta Chem. Scand., 14, 510 – 512.
- ↑ Birgens, H. Lactoferrin in plasma measured by an ELISA technique: evidence that plasma lactoferrin is an indicator of neutrophil turnover and bone marrow activity in acute leukaemia (1985) Scand. J. Haematol., 34(4), 326-331.
- ↑ Baker, H. M., Anderson, B. F., Kidd, R. D., Shewry, S. C., and Baker, E. N. Lactoferrin three-dimensional structure: a framework for interpreting function. In Lactoferrin: Structure, Function and Application (Shimazaki, K., ed.).(2000) pp. 3 – 15, Elsevier Science, Amsterdam.
- ↑ Baker, E. N., Baker, H. M. Molecular structure, binding properties and dynamics of lactoferrin (2005) Cell. Mol. Life Sci., 62, 2531 – 2539.
- ↑ Hakansson, A., Zhivotovsky, B., Orrenius, S., Sabharwal, H., Svanborg, C. Apoptosis induced by a human milk protein (1995) Proc. Natl. Acad. Sci. U S A, 92(17), 8064-8068.
- ↑ Jameson, G.B., Anderson, B.F., Norris, G.E., Thomas, D.H., Baker, E.N. Structure of human apolactoferrin at 2.0 A resolution. Refinement and analysis of ligand-induced conformational change (1998) Acta Crystallogr. D. Biol. Crystallogr., 54, 1319-1335.
- ↑ Levay, P.F., Viljoen, M. Lactoferrin: a general review. (1995) Haematologica., 80(3), 252-267.
- ↑ Mazurier J., SpikG. Comparative study of the iron-binding properties of human transferring. Complete and sequential iron saturation and desaturation of the lactotransferrin. (1980) Biochim. Biophys. Acta, 629, 399-408.
- ↑ 1 2 Sousa, M., Brock, J.H., Iron in immunity. Cancer and Inflammation (1989) John Wiley & Sons.
- ↑ Shongwe, M.S., Smith, C.A., Ainscough, E.C., Baker, H.A., Brodie, A.M., Baker, E.N. Anion binding by human lactoferrin: results from crystallographic and physicochemical studies. (1992) Biochem. J., 31, 4451-4458.
- ↑ 1 2 3 4 Bennett, R.M., Davis, J. Lactoferrin interacts with deoxyribonucleic acid: a preferential reactivity with double-stranded DNA and dissociation of DNA-anti-DNA complexes. (1982) J.Lab. Clin. Med., 99, 127-138.
- ↑ Bagby, G.C.Jr., Bennett, R.M. Feedback regulation of granulopoiesis: polymerization of lactoferrin abrogates its ability to inhibit CSA production (1982) Blood, 60(1), 108-112.
- ↑ Mantel, C., Miyazawa, K., Broxmeyer, H.E. Physical characteristics and polymerization during iron saturation of lactoferrin, a myelopoietic regulatory molecule with suppressor activity (1994) Adv. Exp. Med. Biol., 357, 121-132.
- ↑ 1 2 Furmanski, P., Li, Z.P., Fortuna, M.B., Swamy, C.V., Das, M.R. Multiple molecular forms of human lactoferrin. Identification of a class of lactoferrins that possess ribonuclease activity and lack iron-binding capacity (1989) J. Exp. Med., 170, 415-429.
- ↑ 1 2 Farnaud, S., Evans, R.W. Lactoferrin--a multifunctional protein with antimicrobial properties. (2003) Mol. Immunol. 40(7), 395-405.
- ↑ Xanthou, M. Immune protection of human milk (1998) Biol. Neonate, 74, 121-133.
- ↑ Odell, E.W., Sarra, R., Foxworthy, M., Chapple, D.S., Evans, R.W. Antibacterial activity of peptides homologous to a loop region in human lactoferrin. (1996) FEBS Lett., 382, 175-178.
- ↑ Kuwata, H., Yip, T.T., Yip, C.L., Tomita, M., Hutchens, T.W. Bactericidal domain of lactoferrin: detection, quantitation, and characterization of lactoferricin in serum by SELDI affinity mass spectrometry. (1998) Biochem. Biophys. Res. Commun., 245, 764-773.
- ↑ 1 2 3 4 5 Sojar, H.T., Hamada, N., Genco, R.J. Structures involved in the interaction of Porphyromonas gingivalis fimbriae and human lactoferrin. (1998) FEBS Lett., 422, 205-208.
- ↑ 1 2 van der Strate, B.W., Beljaars, L., Molema, G., Harmsen, M.C., Meijer, D.K. Antiviral activities of lactoferrin. (2001) Antiviral. Res., 52(3), 225-239.
- ↑ Fujihara, T., Hayashi, K. Lactoferrin inhibits herpes simplex virus type-1 (HSV-1) infection to mouse cornea. (1995) Arch.Virol., 140, 1469-1472.
- ↑ 1 2 Giansanti, F., Rossi, P., Massucci, M.T., Botti, D., Antonini, G., Valenti, P., Seganti, L. Antiviral activity of ovotransferrin discloses an evolutionary strategy for the defensive activities of lactoferrin. (2002) Biochem. Cell Biol., 80(1), 125-130.
- ↑ Harmsen, M. C., Swart, P. J., De Bethune, M. P., Pawels, R., De Clercq, E. Antiviral effects of plasma and milk proteins: lactoferrin shows potent activity against both human immunodeficiency virus and human cytomegalovirus replication in vitro. (1995) J. Infect. Dis., 172, 280-288.
- ↑ 1 2 Puddu, P., Borghi, P., Gessani, S., Valenti, P., Belardelli, F., Seganti, L. Antiviral effect of bovine lactoferrin saturated with metal ions on early steps of human immunodeficiency virus type 1 infection. (1998) Int. J. Biochem. Cell Biol., 30(9), 1055-1062.
- ↑ H. S. Azzam1, C. Goertz2, M. Fritts2 and W. B. Jonas Natural products and chronic hepatitis C virus (2007) Liver Int. Feb;27(1):17-25. Review. (2007) Erratum in: Liver Int. Apr;27(3):421.
- ↑ 1 2 3 Nozaki, A., Ikeda, M., Naganuma, A., Nakamura, T., Inudoh, M., Tanaka, K., Kato, N. Identification of a lactoferrin-derived peptide possessing binding activity to hepatitis C virus E2 envelope protein. (2003) J. Biol. Chem., 278(12), 10162-10173.
- ↑ Arnold, D., Di Biase, A.M., Marchetti, M., Pietrantoni, A., Valenti, P., Seganti, L., Superti, F. Antiadenovirus activity of milk proteins: lactoferrin prevents viral infection. (2002) Antiviral Res., 53(2), 153-158.
- ↑ Mirabelli, C., Wotring, J. W., Zhang, C. J., McCarty, S. M., Fursmidt, R., Frum, T., ... & Sexton, J. Z. (2021). Morphological cell profiling of SARS-CoV-2 infection identifies drug repurposing candidates for COVID-19. PNAS, 118(36) e2105815118 PMID 32577649 PMC 7302203 doi:10.1073/pnas.2105815118
- ↑ Renji Reghunathan, Manikandan Jayapal, Li-Yang Hsu, Hiok-Hee Chng, Dessmon Tai, Bernard P Leung and Alirio J Melendez. Expression profile of immune response genes in patients with Severe Acute Respiratory Syndrome // BMC Immunol. — 2005. — № 6. — С. 2.
- ↑ Wakabayashi, H., Uchida, K., Yamauchi, K., Teraguchi, S., Hayasawa, H., Yamaguchi, H. Lactoferrin given in food facilitates dermatophytosis cure in guinea pig models. (2000) J. Antimicrob. Chemother., 46(4), 595-602.
- ↑ 1 2 3 Lupetti, A., Paulusma-Annema, A., Welling, M.M., Dogterom-Ballering, H., Brouwer, C.P., Senesi, S., Van Dissel, J.T., Nibbering, P.H. Synergistic activity of the N-terminal peptide of human lactoferrin and fluconazole against Candida species. (2003) Antimicrob. Agents Chemother., 47(1), 262-267.
- ↑ 1 2 Viejo-Diaz, M., Andres, M.T., Fierro, J.F. Modulation of in vitro fungicidal activity of human lactoferrin against Candida albicans by extracellular cation concentration and target cell metabolic activity. (2004) Antimicrob. Agents Chemother., 48(4), 1242-1248.
- ↑ Van Berkel, P.H., Geerts, M.E., van Veen, H.A., Mericskay, M., de Boier, H., Nuijens, J.H. N-terminal stretch Arg2, Arg3, Arg4 and Arg5 of human lactoferrin is essential for binding to heparin, bacterial lipopolysaccharide, human lysozyme and DNA. (1997) Biochem. J., 328, 145-151.
- ↑ Okamoto, T., Tanida, T., Wei, B., Ueta, E., Yamamoto, T., Osaki, T. Regulation of fungal infection by a combination of amphotericin B and peptide 2, a lactoferrin peptide that activates neutrophils. (2004) Clin. Diagn. Lab. Immunol., 11(6), 1111-1119.
- ↑ Takakura, N., Wakabayashi, H., Ishibashi, H., Teraguchi, S., Tamura, Y., Yamaguchi, H., Abe, S. Oral lactoferrin treatment of experimental oral candidiasis in mice. (2003) Antimicrob. Agents Chemother., 47(8), 2619-2623.
- ↑ Masci, J.R. Complete response of severe, refractory oral candidiasis to mouthwash containing lactoferrin and lysozyme. (2000) AIDS, 14(15), 2403-2404.
- ↑ Kuipers, M.E., de Vries, H.G., Eikelboom, M.C., Meijer, D.K., Swart, P.J. Synergistic fungistatic effects of lactoferrin in combination with antifungal drugs against clinical Candida isolates. (1999) Antimicrob. Agents Chemother., 43(11), 2635-2641.
- ↑ Kanyshkova, T.G., Semenov, D.V., Buneva, V.N., Nevinsky, G.A. Human milk lactoferrin binds two DNA molecules with different affinities. (1999) FEBS Lett., 451, 235-237.
- ↑ Rosenmund, A., Kuyas, C., Haeberli, A. Oxidative radioiodination damage to human lactoferrin. (1986) Biochem. J., 240, 239-245.
- ↑ Devi, A.S., Das, M.R., Pandit, M.W. Lactoferrin contains structural motifs of ribonuclease. (1994) Biochim. Biophys. Acta, 1205(2), 275-281.
- ↑ McCormick, J.J., Larson, L.J., Rich, M.A. RNase inhibition of reverse transcriptase activity in human milk. (1974) Nature, 251, 737-740.
- ↑ Das, M.R., Padhy, L.C., Koshy, R., Sirsat, S.M., Rich, M.A. Human milk samples from different ethnic groups contain RNase that inhibits, and plasma membrane that stimulates, reverse transcription. (1976) Nature, 262, 802-805.
- ↑ 1 2 3 4 5 Бабина, С. Е. Лактоферрин как полифункциональная гидролаза молока человека (2006) Диссертация на соискание уч. ст. канд. хим. наук, Новосибирск.
- ↑ Канышкова, Т. Г. Нуклеазные активности антител и лактоферрина молока человека (1999) Диссертация на соискание уч. ст. канд. хим. наук, Новосибирск.
- ↑ Lohman, T.M. Kinetics of protein-nucleic acid interactions: use of salt effects to probe mechanisms of interaction. (1986) CRC Crit. Rev. Biochem., 19(3), 191-245.
- ↑ Yuan, R. Structure and mechanism of multifunctional restriction endonucleases. (1981) Annu. Rev. Biochem., 50, 285-319.
- ↑ Svensson, B. Protein engineering in the alpha-amylase family: catalytic mechanism, substrate specificity and stability. (1994) Plant. Mol. Biol., 25, 141-157
- ↑ Savel'ev, A.N., Kanyshkova, T.G., Kulminskaya, A.A., Buneva, V.N., Eneyskaya, E.V., Filatov, M.V., Nevinsky, G.A., Neustroev, K.N. Amylolytic activity of IgG and sIgA immunoglobulins from human milk. (2001) Clin. Chim. Acta., 314(1-2), 141-152.
- ↑ 1 2 Jing-Fen Kang, Xiang-Long Li Contact Information, Rong-Yan Zhou, Lan-Hui Li, Fu-Jun Feng and Xiu-Li Guo. Bioinformatics Analysis of Lactoferrin Gene for Several Species // Biochemical Genetics. — 2008. — Т. 46, № 5-6. — С. 312-322.
- ↑ Seyfert HM, Tuckoricz A, Interthal H, Koczan D, Hobom G. Structure of the bovine lactoferrin-encoding gene and its promoter // Gene. — 1994. — Т. 143, № 2. — С. 265-9.
- ↑ O'Halloran F, Bahar B, Buckley F, O'Sullivan O, Sweeney T, Giblin L. Characterisation of single nucleotide polymorphisms identified in the bovine lactoferrin gene sequences across a range of dairy cow breeds // Biochimie. — 2009. — Т. 91, № 1. — С. 68-75.
- ↑ Liao Y, Lopez V, Shafizadeh TB, Halsted CH, Lönnerdal B. Cloning of a pig homologue of the human lactoferrin receptor: expression and localization during intestinal maturation in piglets // Comp Biochem Physiol A Mol Integr Physiol. — 2007. — Т. 148, № 3. — С. 584-90.