Лантан
| Лантан | ||||
|---|---|---|---|---|
| ← Барий | Церий → | ||||
| ||||
| Внешний вид простого вещества | ||||
 Образец лантана в ампуле | ||||
| Свойства атома | ||||
| Название, символ, номер | Лантан / Lanthanum (La), 57 | |||
| Группа, период, блок | 3 (устар. IIIB), 6, f-элемент | |||
| Атомная масса (молярная масса) | 138,90547(7)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe] 5d16s2 | |||
| Радиус атома | 187 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 169 пм | |||
| Радиус иона | 101.(+3e) 6 пм | |||
| Электроотрицательность | 1,10 (шкала Полинга) | |||
| Электродный потенциал | La←La3+ -2,38В | |||
| Степени окисления | 0, +3 | |||
| Энергия ионизации (первый электрон) | 541,1(5,61) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 6,162-6,18 (альфа-модификация) г/см³ | |||
| Температура плавления | 1193 К (919,85 °С) | |||
| Температура кипения | 3447 – 3469 К (3173,85 – 3195,85 °С) | |||
| Мол. теплота плавления | 8,5 кДж/моль | |||
| Мол. теплота испарения | 402 кДж/моль | |||
| Молярная теплоёмкость | 27,11[2] Дж/(K·моль) | |||
| Молярный объём | 22,5 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | Гексагональная | |||
| Параметры решётки | a=3,772 c=12,14 Å | |||
| Отношение c/a | 3,22 | |||
| Температура Дебая | 132 K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 13,4 Вт/(м·К) | |||
| Номер CAS | 7439-91-0 | |||
| 57 | Лантан |
| 5d16s2 | |
Ланта́н (химический символ — La, от греч. λανθάνειν — скрытный, прячущийся) — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы, IIIB) шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 57[3].
Возглавляет семейство лантаноидов.
Простое вещество лантан — блестящий редкоземельный металл серебристо-белого цвета.
История
Лантан как химический элемент не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церит. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мосандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мосандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Происхождение названия
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. λανθάνω — «скрываюсь», «таюсь».
Нахождение в природе
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре порядка 2,9·10−3% по массе, в морской воде — около 2,9·10−6мг/л[2][4]. Основные промышленные минералы лантана — монацит, бастнезит, апатит и лопарит. В состав этих минералов также входят другие редкоземельные элементы[2].
Физические свойства
Полная электронная конфигурация атома лантана: 1s22s22p63s23p63d104s24p65s24d105p66s24f05d1
Лантан — мягкий пластичный блестящий серебристо-белый металл, в чистом состоянии — ковкий и тягучий. Слабо парамагнитен. Кристаллическая структура плотноупакованная типа плотнейшей гексагональной упаковки[5].
Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой (а=0,3772 нм, с=1,2144 нм, z=4, пространственная группа Р63/ттс)[2], β-La с кубической решёткой типа меди (а=0,5296 нм, z=4, пространственная группа Fm3m), γ-La с кубической объёмноцентрированной решёткой типа α-Fe (а=0,426 нм, z=2, пространственная группа Im3m, устойчив до 920 °C) температуры переходов α↔β 277 °C и β↔γ 861 °C[2]. DH° полиморфных переходов: α:β — 0,36 кДж/моль, β:γ — 3,12 кДж/моль[2]. При переходе из одной модификации в другую меняется плотность лантана: α-La имеет плотность 6,162-6,18 г/см3[5], β-La — 6,19 г/см3, γ-La — 5,97 г/см3[2].
С некоторыми металлами, например, с цинком, магнием, кальцием, таллием, оловом, свинцом, никелем, кобальтом, марганцем, ртутью, серебром, алюминием, медью, кадмием и др., металлический лантан образует сплавы. С железом лантан образует пирофорный сплав[5].
Химические свойства
По своим химическим свойствам лантан больше всего похож на 14 следующих за ним элементов, поэтому их называют лантаноидами. Металлический лантан обладает высокой химической активностью[2].
- При 450 °С сгорает в кислороде с образованием оксида лантана(III):
- Медленно реагирует с холодной водой и быстро — с горячей, образуя гидроксид лантана(III)[6]:
- При нагревании лантан вступает в реакции со фтором, хлором, бромом и иодом, давая соответственно фторид, хлорид, бромид и иодид[6]:
- Легко взаимодействует с минеральными кислотами с образованием ионов La3+ и водорода. Вполне возможно, что в водном растворе ион La3+ в значительной степени существует как комплексный ион [La(OH2)9]3+[6]:
Основные соединения
- Ацетилацетонат лантана — органическое соединение, хелат, формула La(С5H7O2)3. Представляет собой бесцветное твёрдое вещество, хорошо растворимое в воде и органических растворителях. Получается реакцией солей лантана со спиртовым раствором ацетилацетона.
- Бензоилацетонат лантана — хелатное соединение лантана, формула La(C10H9O2)3. Образует жёлтые призматические кристаллы. Получается взаимодействием солей лантана со спиртовым раствором бензоилацетона.
- Бромид лантана(III) — бинарное соединение, формула LaBr3. Образует белые кристаллы, хорошо растворимые в воде. Получают действием бромоводорода на оксид или сульфид лантана.
- Гидрид лантана(III) — бинарное соединение, формула LaH3. Представляет собой тёмно-синее кристаллическое вещество; реагирует с водой с образованием гидроксида лантана. Получается действием водорода на лантан при 210—290 °С.
- Гидроксид лантана(III) — белое нерастворимое в воде вещество с формулой La(OH)3. Образуется при действии горячей воды на металлический лантан или на оксид. При температурах выше 300 °С — разлагается.
- Иодид лантана(III) — бинарное соединение, формула LaI3. Образует кристаллы жёлто-зелёного цвета, хорошо растворимые в воде и органических растворителях. Получают нагреванием лантана и иода в инертной атмосфере.
- Карбид лантана(III) — бинарное соединение лантана с углеродом, формула LaС2. Образует жёлтые кристаллы. Реагирует с водой с образованием гидроксида и с выделением этана и ацетилена.
- Карбонат лантана(III) — бесцветное кристаллическое вещество с формулой La2(CO3)2, образует кристаллогидрат состава La2(CO3)2·8H2O. Получается пропусканием углекислого газа через суспензию гидроксида лантана.
- Купферонат лантана — органическое вещество, хелат, формула [La{C6H5N(NO)O}3]. Образует жёлтые кристаллы. Получается реакцией хлорида лантана с раствором купферона в кислой среде.
- Нитрат лантана(III) — бесцветное кристаллическое вещество с формулой La(NO3)3; хорошо растворяется в воде и органических растворителях. Получается растворением лантана, его оксида или гидроксида в азотной кислоте.
- Оксалат лантана(III) — бесцветное вещество, формула La2(C2O4)3. Не растворяется в воде. Получается действием на растворимые соли лантана избытком щавелевой кислоты.
- Оксид лантана(III) — белые кристаллы, формула La2O3. Не растворяется в воде, но медленно реагирует с ней. Получается сгоранием лантана на воздухе или разложением его солей при высоких температурах. Растворяется в кислотах с образованием солей La(III). На воздухе поглощает углекислый газ, постепенно превращаясь в основной карбонат лантана.
- Оксисульфид лантана — желтовато-белые гексагональные кристаллы с формулой La2O2S.
- Оксифторид лантана(III) — бесцветные кристаллы кубической сингонии, формула LaOF. Получают взаимодействием фторида лантана с водяными парами при 800 °С или спеканием оксида лантана с фторидом лантана в вакууме.
- Силицид лантана(III) — бинарное неорганическое соединение, формула LaSi2. Образует серые кристаллы.
- Сульфат лантана(III) — бесцветные кристаллы, растворимые в воде, формула La2(SO4)3. Получается растворением металлического лантана, его оксида или гидроксида в серной кислоте. Разлагается при нагревании.
- Сульфиды лантана — бинарные неорганические соединения лантана и серы. Сульфид лантана(III) имеет формулу La2S3; образует жёлто-красные кристаллы, нерастворимые в воде. Получается действием паров серы на лантан при 600—800 °С. Моносульфид лантана LaS — образует золотистые кристаллы кубической сингонии. Дисульфид лантана LaS2 — коричневые кристаллы.
- Фосфат лантана(III) — бесцветные кристаллы, плохо растворимые в воде, формула LaPO4. Получается обменной реакцией между растворимой солью лантана и фосфатом щелочного металла.
- Фосфид лантана(III) — бинарное неорганическое соединение, чёрные кристаллы с формулой LaP. Получается реакцией лантана и фосфора при 400—500 °С.
- Фторид лантана(III) — бесцветное вещество с формулой LaF3. Не растворяется в воде. Получают взаимодействием лантана с плавиковой кислотой либо прямым сгоранием лантана во фторе.
- Хлорид лантана(III) — бесцветное вещество с формулой LaCl3, хорошо растворимое в воде. Получается реакцией лантана с хлором или взаимодействием его с соляной кислотой.
Минералы
- Бастнезит — минерал класса фторкарбонатов, формула (Ce, La, Y)CO3F. Образует прозрачные кристаллы жёлтого, оранжевого, красного и бурого цветов. Твёрдость по Моосу — 4—4,5; удельный вес — 4,93—5,18. Может содержать от 34,7 до 45,8 % оксида лантана(III)[7].
- Гадолинит — чёрный (чёрно-бурый) минерал с жирным стекловатым блеском, формула (Ce, La, Nd, Y)2FeBe2Si2O10. Твёрдость по шкале Мооса — 6,5-7[8]. Удельный вес — 4-4,3[9]. Состав непостоянен.
- Монацит — минерал класса фосфатов, формула (Ce, La, Nd, Th)[PO4]. Может иметь жёлтую, красновато-бурую, гиацинтово-красную, оливиново-зеленую окраску; цвет черты — белый (зеленовато-белый). Твёрдость по Моосу — 5—5,5; удельный вес — 4,9—5,2[10]. Из-за высокого содержания урана и тория — радиоактивен.
- Ортит — бурый или чёрный минерал, класса силикатов. Химическая формула — (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH)[11]. Твёрдость по Моосу — 5,5-6[12]. Удельный вес составляет 3,3—3,8[13].
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Применение

- Впервые в истории лантан применяли в газокалильных сетках. Австрийский химик Карл Ауэр фон Вельсбах использовал смесь, состоящую из 60 % оксида магния, 20 % оксида иттрия и 20 % оксида лантана, которая получила название Actinophor и была запатентована в 1885 году. Новый осветительный прибор («ауэровский колпачок») давал светло-зелёный свет[14][15].

- Оксид и борид лантана используются в электронно-вакуумных лампах как материал т. н. «горячего катода», то есть катода с высокой интенсивностью потока электронов. Кристаллы LaB6 применяются в источниках катодных лучей для электронных микроскопов[16].
- Лантан применяется как компонент сплавов никеля, магния, кобальта и др.[17]
- Соединение состава La(Ni3.55Mn0.4Al0.3Co0.4Fe0.35) используется для анодного материала никель-металл-гидридных аккумуляторов. Оно представляет собой интерметаллид AB5-типа[18][19].
- Чистый лантан практически не используется по причине своей высокой стоимости; вместо него применяется мишметалл: сплав с содержанием лантана 20—45 %[20][21]. Мишметалл является компонентом жаропрочных и коррозионностойких сплавов[17].
- Для производства типичного гибридного автомобиля Toyota Prius требуется 10—15 кг лантана, где он входит в состав аккумулятора[22][23].
- Карбонат лантана используется как лекарство, имеющее собственное название Fosrenol[24], применяющееся при гиперфосфатемии для поглощения избытка фосфатов[24].
- Лантан имеет свойство поглощать водород. Один объём этого вещества способен поглотить до 400 объёмов водорода в процессе обратимой адсорбции. Это свойство применяется для создания емких аккумуляторов водорода (металлогидридное хранение водорода) и в системах сохранения энергии, так как при растворении водорода в лантане выделяется теплота[21][25].
- Соли лантана и других редкоземельных элементов применяются в угольных дуговых лампах для увеличения яркости дуги[26]. Угольные дуговые лампы были популярны в кинопроекторах. На производство последних приходится около 25 % соединений лантана, которые изначально предполагались для дуговых ламп[21][27].
- Жидким лантаном извлекают плутоний из расплавленного урана[28].
- Небольшая добавка лантана к стали увеличивает её пластичность и деформируемость. Добавка лантана к молибдену уменьшает его твёрдость и чувствительность к перепадам температур[21].
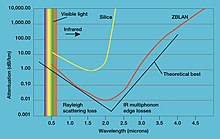
- Фторид лантана — важный компонент люминофоров. В смеси с фторидом европия он используется в кристаллической мембране ионоселективных электродов[29]. Он также входит в состав стекла ZBLAN. Оно обладает улучшенным коэффициентом пропускания в инфракрасном диапазоне и поэтому применяется в волоконной оптике[30].
- Оксид лантана(III) — компонент специальных стёкол, высокотемпературной керамики, применяется также для производства других соединений лантана[21][31].
- Хлорид и бромид лантана применяются как сцинтилляторы с высоким световым выходом, лучшим энергетическим разрешением и временем высвечивания[32][33].
- Оксисульфид и алюминат лантана используются в люминофорах[17][34].
- Ионы лантана, как и пероксидаза хрена, используется в молекулярной биологии для усиления электрического сигнала до уровня, необходимого для детекции[35].
- Бентонитовая глина (т. н. Phoslock), в которой ионы натрия и кальция заменяются на ионы лантана, используется для очистки сточных вод от фосфатов[36].
- Небольшое количество соединений лантана связывает фосфаты в воде, в результате чего останавливается рост водорослей, которым необходимы соединения фосфора. Это свойство может применяться для очистки воды в бассейнах[37].
- Некоторые соединения лантана (и других редкоземельных элементов), например, хлориды и оксиды являются компонентами различных катализаторов, применяемых в частности, для крекинга нефти[38].
- Добавка оксида лантана (La2O3) к вольфраму используется при дуговой сварке вольфрамовым электродом[англ.], как замена радиоактивному торию[39][40].
- Лантан-бариевый метод радиометрического датирования иногда используется для оценки возраста горных пород и месторождений полезных ископаемых[41].
Биологическая роль
В 1930-х годах советский учёный А. А. Дробков исследовал влияние редкоземельных металлов на культурные растения. Он проводил опыты с горохом, репой и другими растениями, вводя в грунт редкоземельные элементы (РЗЭ) вместе с бором, марганцем или без них. Результаты опытов показывали, что редкоземельные элементы, в том числе лантан, улучшают рост растений[28][42][43]. Однако использование микроудобрений на основе лантана и других РЗЭ приводит к противоположным результатам для разных видов и даже сортов одного вида культурных растений[44]. В Китае, являющемся ведущим мировым производителем РЗЭ, такие микроудобрения массово применяются в сельском хозяйстве[44][45].
Ионы лантана способны увеличивать амплитуду ГАМК-активированных сигналов на пирамидальных нейронах гена CA1[англ.], отмеченных в гиппокампе головного мозга[46]. Получение этих данных позволило сравнить чувствительность рецепторов ГАМКA пирамидальных нейронов с аналогичными рецепторами других клеток по восприимчивости к ГАМК и ионам лантана[46].
Изотопы
В природе лантан встречается в виде смеси двух изотопов: стабильного 139La и радиоактивного 138La (период полураспада 1,02⋅1011 лет). Доля более распространённого изотопа 139La в природной смеси составляет 99,911 %[17]. Искусственно получены 39 неустойчивых изотопов с массовыми числами 117—155 и 12 ядерных изомеров лантана[47][48]. Наиболее долгоживущим из них является лантан-137 с периодом полураспада около 60 тыс. лет. Остальные изотопы имеют периоды полураспада от нескольких миллисекунд до нескольких часов.
Меры предосторожности
Лантан относится к умеренно-токсичным веществам. Металлическая пыль лантана, а также мелкие частицы его соединений могут раздражать верхние дыхательные пути при попадании их внутрь, а также вызвать пневмокониоз[49][50].
См. также
- Мишметалл — сплав лантана с другими редкоземельными элементами.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 4 5 6 7 8 Химическая энциклопедия: в 5 тт / Редкол.:Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 577. — 671 с. — 100 000 экз.
- ↑ English: Kazakh Encyclopediasy Limited Liability Partnership, Start this Book. Русский: Казахстан. Национальная энциклопедия. Дата обращения: 3 марта 2023.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- ↑ 1 2 3 Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- ↑ 1 2 3 Chemical reactions of the elements (англ.). WebElements. Дата обращения: 16 июля 2013. Архивировано 22 октября 2021 года.
- ↑ Бастнезит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Gadolinite (англ.). База данных mindat.org. Дата обращения: 21 июля 2013. Архивировано 19 августа 2013 года.
- ↑ Гадолинит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Лантан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Allanite (англ.). Ортит в галерее минералов. Дата обращения: 21 июля 2013. Архивировано 25 июля 2013 года.
- ↑ Allanite (англ.). База данных mindat.org. Дата обращения: 21 июля 2013. Архивировано 25 мая 2009 года.
- ↑ Ортит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Lighting. 11th edition of Encyclop?dia Britannica (1911). Дата обращения: 6 июня 2009. Архивировано из оригинала 5 января 2013 года.
- ↑ Освещение калильное // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Jason D. Sommerville and Lyon B. King. [http://www.me.mtu.edu/researchAreas/isp/Papers/AIAA-2007-5174-907.pdf Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage] (англ.) // 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8–11 July 2007, Cincinnati, OH : journal. Архивировано 4 марта 2016 года.
- ↑ 1 2 3 4 [www.xumuk.ru/encyklopedia/2271.html Статья в Большой Химической Энциклопедии]
- ↑ Inside the Nickel Metal Hydride Battery. Дата обращения: 6 июня 2009. Архивировано из оригинала 5 января 2013 года.
- ↑ Tliha, M; Mathlouthi, H; Lamloumi, J; Percheronguegan, A. AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries (англ.) // Journal of Alloys and Compounds : journal. — 2007. — Vol. 436. — P. 221. — doi:10.1016/j.jallcom.2006.07.012.
- ↑ Mischmetal —Encyclopedia Britannica. Дата обращения: 28 декабря 2012. Архивировано 18 июня 2013 года.
- ↑ 1 2 3 4 5 C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st edition (англ.). — CRC press, 2000. — ISBN 0-8493-0481-4.
- ↑ "As hybrid cars gobble rare metals, shortage looms". Reuters 2009-08-31. 2009-08-31. Архивировано 25 октября 2021. Дата обращения: 2 октября 2017.
- ↑ Bauerlein, P; Antonius, C; Loffler, J; Kumpers, J. Progress in high-power nickel–metal hydride batteries (англ.) // Journal of Power Sources[англ.] : journal. — 2008. — Vol. 176, no. 2. — P. 547. — doi:10.1016/j.jpowsour.2007.08.052.
- ↑ 1 2 FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients (28 октября 2004). Дата обращения: 6 июня 2009. Архивировано из оригинала 26 апреля 2009 года.
- ↑ Uchida, H. Hydrogen solubility in rare earth based hydrogen storage alloys (англ.) // International Journal of Hydrogen Energy : journal. — 1999. — Vol. 24, no. 9. — P. 871. — doi:10.1016/S0360-3199(98)00161-X.
- ↑ Дуговая угольная лампа — статья из Большой советской энциклопедии (3-е издание)
- ↑ Hendrick, James B. Rare Earth Elements and Yttrium // Mineral Facts and Problems (неопр.). — Bureau of Mines, 1985. — Т. Bulletin 675. — С. 655. Архивировано 4 марта 2016 года.
- ↑ 1 2 Лантан в Популярной библиотеке химических элементов. Дата обращения: 25 марта 2007. Архивировано 25 февраля 2020 года.
- ↑ Patnaik, Pradyot. Handbook of Inorganic Chemical Compounds (неопр.). — McGraw-Hill Education, 2003. — С. 444—446. — ISBN 0-07-049439-8.
- ↑ Harrington, James A. Infrared Fiber Optics (PDF). Rutgers University. Дата обращения: 31 декабря 2012. Архивировано из оригинала 16 декабря 2009 года.
- ↑ Kim, K. The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering (англ.) // Materials Characterization : journal. — 2003. — Vol. 50. — P. 31. — doi:10.1016/S1044-5803(03)00055-X.
- ↑ E. V. D. van Loef, P. Dorenbos, C. W. E. van Eijk, K. W. Kraemer and H. U. Guedel Appl. Phys. Lett. 79 2001 1573
- ↑ Knoll, Glenn F., Radiation Detection and Measurement 3rd ed. (Wiley, New York, 2000).
- ↑ Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- ↑ Chau Y.P., Lu K.S. Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers (англ.) // Acta Anatomica (Basel) : journal. — 1995. — Vol. 153, no. 2. — P. 135—144. — ISSN 0001-5180. — doi:10.1159/000313647. — PMID 8560966.
- ↑ Hagheseresht et al. A novel lanthanum-modified bentonite, Phoslock, for phosphate removal from wastewaters (англ.) // Applied Clay Science : journal. — 2009. — Vol. 46, no. 4. — P. 369—375.
- ↑ Phosphate in Swimming Pool Water — The Root of Algae Problems
- ↑ C. K. Gupta, Nagaiyar Krishnamurthy. Extractive metallurgy of rare earths (неопр.). — CRC Press, 2004. — С. 441. — ISBN 0-415-33340-7.
- ↑ Howard B. Cary. Arc welding automation (неопр.). — CRC Press, 1995. — С. 139. — ISBN 0-8247-9645-4.
- ↑ Larry Jeffus. Types of Tungsten // Welding : principles and applications (неопр.). — Clifton Park, N.Y.: Thomson/Delmar Learning, 2003. — С. 350. — ISBN 978-1-4018-1046-7.
- ↑ S. Nakai, A. Masuda, B. Lehmann. La-Ba dating of bastnaesite (англ.) // American Mineralogist[англ.] : journal. — 1988. — Vol. 7. — P. 1111. Архивировано 31 октября 2021 года.
- ↑ Дробков А. А. Влияние редкоземельных элементов на рост растений. «Доклады АН СССР», 1935, 17(5), 261—263.
- ↑ Дробков А. А. Микроэлементы и естественные радиоактивные элементы в жизни растений и животных / Отв. ред. Н. Г. Жежель. — М. : Изд-во АН СССР, 1958. — 208 с.
- ↑ 1 2 Комаров С. М. Редкая соль земли. Химия и жизнь, № 5, 2013, с. 20—22.
- ↑ Zhengyi Hu et al. Physiological and Biochemical Effects of Rare Earth Elements on Plants and Their Agricultural Significance: A Review. Journal оf Plant Nutrition, 2004, 27(1), p. 183—220.
- ↑ 1 2 Boldyreva, A. A. Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field (англ.) // Bulletin of Experimental Biology and Medicine : journal. — 2005. — Vol. 140, no. 4. — P. 403—405. — doi:10.1007/s10517-005-0503-z. — PMID 16671565.
- ↑ Данные приведены по Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — .
- ↑ Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — .

- ↑ Dufresne, A; Krier, G; Muller, J; Case, B; Perrault, G. Lanthanide particles in the lung of a printer (англ.) // Science of the Total Environment[англ.] : journal. — 1994. — Vol. 151, no. 3. — P. 249—252. — doi:10.1016/0048-9697(94)90474-X. — PMID 8085148.
- ↑ Waring, PM; Watling, R.J. Rare earth deposits in a deceased movie projectionist. A new case of rare earth pneumoconiosis (англ.) // The Medical journal of Australia[англ.] : journal. — 1990. — Vol. 153, no. 11—12. — P. 726—730. — PMID 2247001.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Ссылки
- Lanthanum (англ.). WebElements. Дата обращения: 25 июля 2013.