Бактериофа́ги, или фа́ги (от др.-греч. φᾰ́γω — «пожираю»), — вирусы, заражающие бактериальные клетки. Ранее бактериофагами называли и вирусы архей, однако в настоящее время этот термин принято относить исключительно к бактериальным вирусам. Бактериофаги, как и любые иные вирусы, размножаются внутри клетки хозяина. Высвобождение потомства большинства бактериофагов происходит путём лизиса инфицированной бактериальной клетки, однако при размножении бактериофагов некоторых групп, например, нитчатых фагов, выход вирусных частиц происходит без разрушения клетки, которая сохраняет свою жизнеспособность. Вирусная частица или вирион бактериофага состоит из оболочки, как правило белковой, и генетического материала — одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Общая численность бактериофагов в большинстве природных местообитаний примерно равна численности бактерий или превышает ее в 2—10 раз, при этом общее количество фаговых частиц в биосфере Земли составляет 1030—1032 частиц. Бактериофаги активно участвуют в круговороте химических веществ и энергии, оказывают заметное влияние на состав, динамику и активность микробных сообществ, влияют на эволюцию микробов, на их взаимодействия между собой и с многоклеточными организмами и даже участвуют в контроле экспрессии собственных генов микроорганизмов. У бактерий существует также большое число генетических элементов и кодируемых ими молекулярных структур, имеющих общее происхождение с бактериофагами, «приспособленных» микробами для тех или иных собственных нужд: дефектные профаги, бактериоцины типов R и F, AFP-профаги (от англ. antifeeding prophage — профаги, препятствующие питанию), системы секреции VI типа (T6SS), сократимые системы, ассоциированные с метаморфозом (MAC), агенты переноса генов (GTA — gene tranfer agents) и другие. Бактериофаги, а также антивирусные (противофаговые) системы бактерий послужили источником большей части инструментария современной генетической инженерии и ряда других технологий.
Промо́тор — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции. Промотор играет одну из ключевых ролей в процессе инициации транскрипции.

p53 — это транскрипционный фактор, регулирующий клеточный цикл. p53 выполняет функцию супрессора образования злокачественных опухолей, соответственно ген TP53 является антионкогеном. Мутации гена TP53 обнаруживаются в клетках около 50 % раковых опухолей. Зачастую его называют «стражем генома».

Гомеодомен — это структурный домен белков, связывающих ДНК или РНК, широко распространенный среди факторов транскрипции. Домен состоит из 60 остатков аминокислот, и образует структуру спираль-поворот-спираль, в которой альфа-спирали связаны короткими петлевыми участками. Две спирали на N-конце являются антипараллельными, и длиннее спирали на C-конце, которая перпендикулярна осям N-концевым петлям. Непосредственно С-концевая спираль взаимодействует с ДНК. Укладка доменов белков по типу гомеодомена встречается исключительно у эукариот, но гомологична белкам фага лямбда, которые изменяют экспрессию генов прокариот. У эукариот гомеодомены индуцируют дифференцировку клеток, запуская каскады генов, необходимых для образования тканей и органов.

Пол Наим Берг — американский биохимик, лауреат Нобелевской премии по химии. Эмерит-профессор Стэнфордского университета, член НАН США и Американского философского общества (1983), иностранный член Французской академии наук (1981) и Лондонского королевского общества (1992). Также удостоен Национальной научной медали (1983) и других наград.

Триптофа́новый оперо́н — оперон, содержащий гены ферментов, задействованных в биосинтезе аминокислоты триптофан. Триптофановый оперон имеется у многих бактерий, впервые был описан у Escherichia coli. Триптофановый оперон является важной экспериментальной моделью для изучения регуляции экспрессии генов.
Суперинфекция — процесс, в результате которого клетка, изначально зараженная одним вирусом, коинфицируется через какое-то время другим штаммом вируса или другим вирусом. Вирусные суперинфекции могут привести к появлению резистентных штаммов вирусов, для лечения которых потребуются иные препараты. Например, коинфекция человека двумя разными штаммами вируса ВИЧ может привести к образованию штамма, резистентного к антиретровирусной терапии. Также показано, что комбинированная инфекция уменьшает общую эффективность иммунного ответа.

V(D)J-рекомбина́ция, или V(D)J-реаранжиро́вка , — механизм соматической рекомбинации ДНК, происходящий на ранних этапах дифференцировки лимфоцитов и приводящий к формированию антиген-распознающих участков антител и Т-клеточного рецептора. Гены иммуноглобулинов и Т-клеточных рецепторов состоят из повторяющихся сегментов, принадлежащих к трём классам: V, D и J. В процессе V(D)J-перестройки генные сегменты, по одному из каждого класса, соединяются вместе. Объединённая последовательность сегментов V(D)J кодирует вариабельные домены каждой из цепей рецептора или антитела.

SOS-систе́ма — защитная система бактерий, которая активируется в ответ на серьёзные повреждения ДНК или ингибирование репликации и запускает сложную цепочку защитных реакций, в том числе экспрессию многих генов, связанных с репарацией. Физиологические изменения в клетке под действием SOS-системы называются SOS-ответом. Ключевую роль в запуске SOS-системы играет белок RecA. Он активирует саморасщепление белка LexA, который в нормальных условиях подавляет экспрессию генов SOS-системы.
Корепрессор — вещество, которое ингибирует экспрессию генов. Для прокариот корепрессорами являются низкомолекулярные вещества или малые молекулы, тогда как в эукариотах, корепрессорами являются белки. Корепрессоры непосредственно не связывают ДНК, но вместо этого косвенно регулируют экспрессию гена путём связывания с репрессорами и усиливают или модулируют их действие.
В молекулярной биологии индуктор представляет собой молекулу, которая регулирует экспрессию генов. Индуктор может связываться с репрессором или активатором.

Репрессор — ДНК-связывающий или РНК-связывающий белок, который ингибирует экспрессию одного или нескольких генов путём связывания с оператором или сайленсерами. ДНК-связывающий репрессор блокирует прикрепление РНК-полимеразы к промотору, предотвращая таким образом транскрипцию генов в мРНК. РНК-связывающий репрессор связывается с мРНК и предотвращает трансляцию мРНК в белок. Эта блокировка экспрессии называется репрессией.
Лакто́зный репре́ссор — ДНК-связывающий белок, который ингибирует экспрессию генов, кодирующих белки лактозного оперона. Кодируется геном lacI. Белки лактозного оперона участвуют в метаболизме лактозы в клетках бактерий. Эти гены подавляются, когда лактоза недоступна клеткам, гарантируя, что бактериальная клетка не будет тратить энергию на синтез белков, метаболизирующих лактозу, в условиях её отсутствия. Когда лактоза становится доступной, она преобразуется в аллолактозу, которая ингибирует способность лактозного репрессора связываться с ДНК. Когда репрессор не связан с оператором лактозного оперона, начинаются его транскрипция и последующий синтез ферментов метаболизма лактозы.
Галактозный оперон — прокариотический оперон, кодирующий ферменты, необходимые для метаболизма галактозы. Оперон содержит два оператора, OE и OI. Первый расположен непосредственно перед промотором, а второй после гена GalE .
Арабино́зный оперо́н — бактериальный оперон, кодирующий белки, необходимые для метаболизма арабинозы. Он подчиняется как позитивному, так и негативному контролю: экспрессию оперона стимулирует субстрат, то есть арабиноза, но при наличии глюкозы в среде его экспрессия подавлена. В состав арабинозного оперона входит три структурных гена: araB, araA и araD, а также регуляторный ген araC, сцеплённый со структурными генами, и регуляторные участки. Арабинозный оперон был открыт и исследован у кишечной палочки в 1970-х.
Эксцизио́нная репара́ция нуклеоти́дов — один из механизмов репарации ДНК. Наряду с эксцизионной репарацией оснований и репарацией ошибочно спаренных нуклеотидов, он позволяет исправить однонитевые повреждения ДНК, используя в качестве матрицы неповреждённую комплементарную цепь. В отличие от вышеуказанных механизмов, NER предназначен для более крупных повреждений ДНК, таких как пиримидиновые димеры, образующиеся в ДНК под действием ультрафиолета (УФ).

Эксцизио́нная репара́ция основа́ний — система репарации ДНК, удаляющая из двойной спирали повреждённые азотистые основания. BER начинается с распознавания и удаления повреждённого основания ДНК-гликозилазами. Далее особая эндонуклеаза удаляет фрагмент цепи, содержащий нуклеотид без основания, и ДНК-полимеразы застраивают брешь. Различают BER с точечной заплаткой, при которой удаляется только нуклеотид, лишённый азотистого основания, или BER с короткой заплаткой, при которой удаляется короткий фрагмент, содержащий повреждённый нуклеотид.

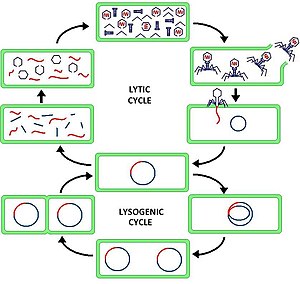
Лити́ческий ци́кл, или лити́ческая инфе́кция — тип жизненного цикла бактериофагов, при котором вскоре после заражения бактериальной клетки вирус воспроизводит себя и далее убивает клетку-хозяина. В ходе литического цикла геномная ДНК фага проникает в клетку-хозяина, где происходит транскрипция вирусных генов и репликация его генетического материала, кроме того, синтезируются белки капсида и прочие вирусные белки, в том числе входящие в состав зрелого вириона. В конце концов наступает лизис клетки, откуда выходят новообразованные вирусные частицы.
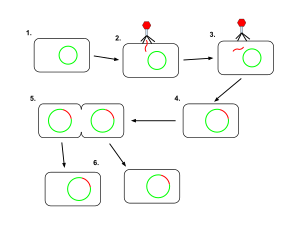
Фаг P1 — умеренный бактериофаг, поражающий кишечную палочку и некоторые другие бактерии. При прохождении лизогенного цикла геном фага существует в виде плазмиды в бактерии, в отличие от других фагов, которые интегрируются в ДНК хозяина. P1 имеет икосаэдрическую головку, содержащую ДНК, прикреплённую к сократительному хвосту с шестью хвостовыми волокнами. Фаг P1 привлёк интерес исследователей, потому что его можно использовать для переноса ДНК из одной бактериальной клетки в другую в процессе, известном как трансдукция. При репликации во время своего литического цикла он захватывает фрагменты хромосомы хозяина. Если полученные вирусные частицы используются для заражения другого хозяина, захваченные фрагменты ДНК могут быть интегрированы в геном нового хозяина. Этот метод генной инженерии in vivo широко использовался в течение многих лет и используется до сих пор, хотя и в меньшей степени. P1 также можно использовать для создания производного от P1 вектора клонирования искусственной хромосомы, который может нести относительно большие фрагменты ДНК. P1 кодирует сайт-специфическую рекомбиназу Cre, которая широко используется для проведения клеточно-специфичной или специфичной по времени рекомбинации ДНК путем фланкирования ДНК-мишени сайтами loxP.