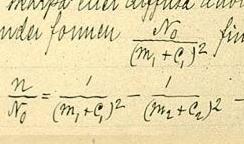А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его химических свойств.

Спектра́льная ли́ния — узкий участок энергетического спектра, где интенсивность излучения усилена либо ослаблена по сравнению с соседними областями спектра. В первом случае линия называется эмиссионной линией, во втором — линией поглощения. Положение линии в электромагнитном спектре обычно задаётся длиной волны, частотой или энергией фотона. Кроме электромагнитного спектра, спектральные линии могут возникать в спектрах энергии частиц, в спектрах звуковых колебаний и вообще любых волновых процессов. Ниже, если нет специальных оговорок, имеются в виду электромагнитные спектры.
Эффе́кт Зе́емана — расщепление линий атомных спектров в магнитном поле. Назван в честь Питера Зеемана, открывшего эффект в 1896 году.

Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам, молекулам, атомным ядрам и т. д.

Эмиссионная (самосветящаяся) туманность — межзвёздное облако, излучающее в оптическом диапазоне из-за ионизации собственного газа. В спектрах таких туманностей видны сильные эмиссионные линии, в том числе запрещённые, на фоне слабого непрерывного спектра. Эмиссионные туманности могут иметь различную природу: это могут быть, например, области H II или планетарные туманности.
А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу  ангстрема.
ангстрема.
Спектра́льный терм - состояние атома, молекулы или иона, в котором определены их полный орбитальный момент и мультиплетность. Иногда под словом терм понимают собственно энергию данного уровня. Переходы между термами определяют спектры испускания и поглощения электромагнитного излучения.

Сверхто́нкая структу́ра — расщепление спектральных линий вследствие взаимодействия электронной оболочки атомов со спином ядра, а также вследствие существования различных изотопов элементов, отличающихся массой и магнитным моментом ядра.

Бо́ровская моде́ль а́тома — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Эрнестом Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка:  .
.

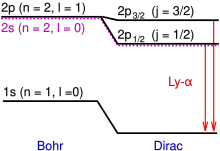
Се́рия Ла́ймана — серия спектральных линий в спектре атома водорода. Эта серия образуется при переходах электронов с возбуждённых энергетических уровней на первый невозбуждённый уровень основного состояния атома водорода в спектре излучения и с первого уровня на все остальные в спектре поглощении.

Спектра́льные се́рии водо́рода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга:

- где R = 109 677 см−1 — постоянная Ридберга для водорода,
- n′ — основной уровень серии, n — натуральное число больше n′.
Се́рия Ба́льмера — одна из спектральных серий атома водорода, наблюдающаяся для переходов между вторым энергетическим уровнем атома и вышележащими уровнями. В отличие от ультрафиолетовой серии Лаймана, связанной с переходами на основной уровень, четыре первые линии серии Бальмера лежат в видимой области спектра.

Лес Лайман-альфа (Lyα-лес) — многократное повторение абсорбционной линии Лайман-альфа в спектрах далеких астрономических объектов. Для очень далёких объектов это явление может быть настолько сильным, что вызывает значительный спад интенсивности в некотором интервале частот; это называется эффектом Ганна — Петерсона.
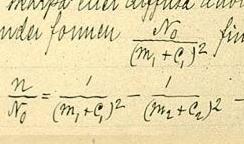
Фо́рмула Ри́дберга — эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и представлена 5 ноября 1888 года.
Возникнове́ние ква́нтовой фи́зики — процесс длительный и постепенный, который занял свыше 25 лет. От первого возникновения понятия кванта до разработки так называемой копенгагенской интерпретации квантовой механики прошло 27 лет, заполненных интенсивной работой учёных всей Европы. В развитии и понимании квантовой теории приняли участие очень многие люди, как старшего поколения — Макс Борн, Макс Планк, Пауль Эренфест, Эрвин Шрёдингер, так и совсем молодые, ровесники квантовой гипотезы — Вернер Гейзенберг (1901), Вольфганг Паули (1900), Поль Дирак (1902) и т. д.
Ста́рая ква́нтовая тео́рия — подход к описанию атомных явлений, который был развит в 1900—1924 годах и предшествовал созданию квантовой механики. Характерная черта этой теории — одновременное использование классической механики и некоторых предположений, вступавших в противоречие с ней. Основа старой квантовой теории — модель атома Бора, к которой позднее Арнольд Зоммерфельд добавил квантование z-компоненты углового момента, неудачно названное пространственным квантованием. Квантование z-компоненты дало возможность ввести эллиптические электронные орбиты и предложить концепцию энергетического вырождения. Успех старой квантовой теории состоял в корректном описании атома водорода и нормального эффекта Зеемана.

H-альфа — спектральная линия серии Бальмера атома водорода, длина волны составляет 656,28 нм. Принадлежит видимой части спектра, имеет тёмно-красный цвет. Излучение данной линии возникает при переходе электрона с третьего на второй энергетический уровень. В астрономии излучение в линии Hα наблюдается в спектрах эмиссионных туманностей, используется для исследования свойств явлений в атмосфере Солнца.

Эквивалентная ширина спектральной линии является мерой площади линии на графике зависимости интенсивности от длины волны. Он определяется путём формирования прямоугольника с высотой, равной высоте непрерывного излучения, и определения ширины, при которой площадь прямоугольника равна площади спектральной линии. Это мера силы спектральных особенностей, которая в основном используется в астрономии.

Фотоны лаймановского континуума — фотоны, испущенные звездой, с энергиями выше энергии лаймановского предела. Водород ионизуется при поглощении фотонов лаймановского континуума. Начиная с момента открытия Виктором Шуманном ультрафиолетового излучения, с 1906 по 1914 годы Теодор Лайман наблюдал, что атомарный водород поглощает свет только с определёнными частотами, поэтому одна из серий водородных линий и носит название лаймановской серии. Все длины волн в серии Лаймана находятся в ультрафиолетовой части спектра. Дискретность поглощения проявляется только до предела энергии, известного как энергия ионизации. В случае нейтрального атома водорода минимальная энергия соответствует лаймановскому пределу, при котором вся энергия фотона затрачивается на отрыв электрона от атома, вследствие чего образуется свободный протон и свободный электрон. Фотоны с энергией выше предельной будут поглощаться атомом, что даёт континуум в энергетическом спектре, то есть непрерывный спектр.
Спектроскопия многократно ионизованных атомов - этот раздел спектроскопии имеет дело с излучением атомов, лишенных нескольких электронов. МИА наблюдаются в очень горячей плазме или в экспериментах на ускорителях. Самые низковозбужденные электронные оболочки МИА обычно распадаются в стабильные основные состояния с испусканием фотонов в вакуумном ультрафиолете и мягкой рентгеновской области спектра.