
Антитела́, иммуноглобулины — крупные глобулярные белки плазмы крови, выделяющиеся плазматическими клетками иммунной системы и служащие для нейтрализации клеток патогенов и вирусов, а также белковых ядов и некоторых других чужеродных веществ. Каждое антитело распознаёт уникальный элемент патогена, отсутствующий в самом организме, — антиген, а в пределах данного антигена — определённый его участок, эпитоп. Связываясь с антигенами на поверхности патогенов, антитела могут либо непосредственно нейтрализовать их, либо привлекать другие компоненты иммунной системы, такие как система комплемента и фагоциты, чтобы уничтожить чужеродные клетки или вирусные частицы. Антитела — важнейший компонент гуморального специфического иммунитета.
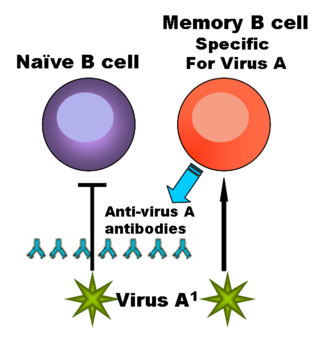
— функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета. При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. Помимо продукции антител, В-клетки выполняют множество других функций: выступают в качестве антигенпрезентирующих клеток, продуцируют цитокины и экзосомы.

Кристаллизующийся фрагмент иммуноглобулина — концевая часть молекулы иммуноглобулина, которая взаимодействует с Fc-рецептором на поверхности клетки и с некоторыми белками системы комплемента. Данное свойство позволяет антителам активировать иммунную систему. Fc-участок изотипов IgG, IgA и IgD состоит из двух одинаковых белковых фрагментов, соответственно, второго и третьего константных доменов двух тяжелых цепей; в случае изотипов IgM и IgE Fc содержит три константных домена тяжелых цепей в каждой полипептидной цепочке.
Тяжёлые цепи иммуноглобулинов — это большие полипептидные субъединицы иммуноглобулинов (антител).
Внутривенные иммуноглобулины получают из препаратов донорской крови и вводят внутривенно. IVIg содержат иммуноглобулины класса G от тысяч доноров. Внутривенные иммуноглобулины применяют при иммунодефицитных состояниях, например, при Х-связанной агаммаглобулинемии, при вторичных иммунодефицитах, при воспалениях и аутоиммунных заболеваниях, при острых инфекциях.

V(D)J-рекомбина́ция, или V(D)J-реаранжиро́вка , — механизм соматической рекомбинации ДНК, происходящий на ранних этапах дифференцировки лимфоцитов и приводящий к формированию антиген-распознающих участков антител и Т-клеточного рецептора. Гены иммуноглобулинов и Т-клеточных рецепторов состоят из повторяющихся сегментов, принадлежащих к трём классам: V, D и J. В процессе V(D)J-перестройки генные сегменты, по одному из каждого класса, соединяются вместе. Объединённая последовательность сегментов V(D)J кодирует вариабельные домены каждой из цепей рецептора или антитела.
Пре-B-клеточный рецептор — рецепторный белковый комплекс, который присутствует на плазматической мембране предшественников B-клеток в течение короткого времени и служит сигналом завершения продуктивной соматической рекомбинации генов тяжёлых цепей иммуноглобулинов. Хотя пре-В-клеточный рецептор синтезируется в клетке только в течение короткого промежутка времени, это событие, тем не менее, является важной контрольной точкой в развитии В-лимфоцита. Его присутствие на мембране показывает, что клетки способны синтезировать нормальные тяжёлые цепи иммуноглобулинов, и только такие клетки могут продолжать своё развитие, в противном случае они погибают в результате апоптоза. Синтез пре-B-клеточного рецептора знаменует переход от про-B-клеток к пре-B-клеткам.

CD20, или B-лимфоцитарный антиген CD20 — белок, корецептор, расположенный на поверхности B-лимфоцитов. Продукт гена человека MS4A1. Точная функция этого белка до сих пор не установлена, однако предполагают, что он принимает участие в активации и пролиферации B-лимфоцитов.

IGLL1 — белок, который у человека кодируется геном IGLL1. IGLL1 структурно гомологичен константному домену λ-цепи иммуноглобулинов и является компонентом пре-B-клеточного рецептора. IGLL1 играет важную роль в развитии B-лимфоцитов. Дефекты гена IGLL1 являются причиной агаммаглобулинемии типа 2.

Иммуноглобули́ны G (IgG) — класс антител. IgG составляют около 75 % антител плазмы крови у человека и являются наиболее часто встречаемыми в кровотоке антителами. IgG продуцируются плазматическими B-клетками, и каждая молекула IgG имеет два сайта связывания антигена.

Антитела́ из тяжёлых цепе́й — класс антител, у которых имеются лишь две тяжёлые цепи и отсутствуют две лёгкие. Они связывают антигены вариабельными доменами, расположенными на тяжёлых цепях (VH), в отличие от обычных антител, у которых во взаимодействии с антигеном также принимают участие вариабельные домены лёгких цепей (VL). В природе антитела из тяжёлых цепей имеются только у хрящевых рыб и верблюдовых, но на их основе разрабатываются искусственные терапевтические фрагменты антител — так называемые однодоменные антитела.

Иммуноглобули́ны M (IgM) — класс антител. Молекулы IgM являются самыми тяжёлыми и наиболее сложно организованными иммуноглобулинами. Молекула свободного IgM представляет собой пентамер, каждый мономер которого состоит из двух тяжёлых цепей (μ-цепей) и двух лёгких цепей κ- или λ-типов. Мономеры объединены в пентамер посредством дисульфидных мостиков и J-цепи. При первичном попадании в организм антигена иммуноглобулины IgM из всех антител образуются первыми. Кроме того, они первыми появляются в онто- и филогенезе. У человека и других млекопитающих IgM синтезируются плазматическими клетками, находящимися в селезёнке. IgM наиболее активны в антибактериальном иммунитете и при ряде аутоиммунных заболеваний.
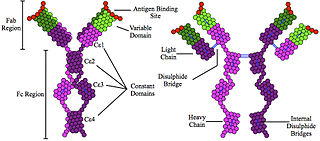
Иммуноглобули́ны E (IgE) — класс антител, имеющийся только у млекопитающих. Молекула IgE состоит из двух тяжёлых цепей (ε-цепи) и двух лёгких цепей κ- или λ-типов. Содержание IgE в плазме крови очень мало, а их основная роль заключается в развитии аллергических реакций, кроме того, они участвуют в иммунном ответе на паразитов, таких как гельминты.

Иммуноглобули́ны D (IgD) — класс антител. На долю IgD приходится 1 % мембранных белков незрелых B-лимфоцитов, причём обычно IgD экспрессируются вместе с другими мембранными антителами, называемыми иммуноглобулинами M (IgM). В плазме крови IgD присутствует в очень небольшом количестве и составляет 0,25 % от всех иммуноглобулинов плазмы крови. Молекула IgD представляет собой мономер с двумя тяжёлыми δ-цепями и двумя лёгкими цепями.

Иммуноглобули́ны A (IgA) — класс антител. IgA доминируют в секретах организма, их доля в плазме крови составляет 10—15 % от общего количества всех иммуноглобулинов. За сутки в просвет кишечника у человека выделяется от 3 до 5 г IgA. У человека имеются два подкласса IgA: IgA1 и IgA2. IgA присутствуют в организме преимущественно в мономерной и димерной форме. Молекулы IgA1 наиболее многочисленны в плазме крови, а IgA2 — в секретах. Соотношение клеток, секретирующих IgA1 и IgA2, различно в разных лимфоидных тканях.

Белок Бенс-Джонса — легкие цепи моноклональных иммуноглобулинов в моче, секретируемые опухолевыми клетками. Обнаружение белка Бенс-Джонса может свидетельствовать о миеломной болезни или макроглобулинемии Вальденстрема. У здоровых людей небольшое количество свободных легких цепей продуцируется постоянно, наряду с полными молекулами иммуноглобулинов. В связи с небольшой молекулярной массой и нейтральным зарядом они фильтруются в первичную мочу через базальную мембрану клубочка, затем реабсорбируются и подвергаются метаболизму в проксимальных канальцах, не попадая в конечную мочу. При появлении злокачественных клеток, происходит переизбыток свободных легких цепей в первичной моче и появлению белка Бенс-Джонса в конечной моче, что также может свидетельствовать о нарушениях в работе почек. При обнаружении белка Бенс-Джонса в моче необходимо его типирование, оценка соотношения каппа- и лямбда-цепей для оценки рисков и вероятных механизмов патогенного воздействия на почки. Выделение белка Бенс-Джонса может сопровождать поражение почечных канальцев при миеломной болезни может сопровождаться развитием вторичного синдрома Фанкони с нормогликемической глюкозурией, аминоацидурией, фосфатурией и проксимальным канальцевым ацидозом с мышечной слабостью и недостаточной минерализацией костей. Белок Бенс-Джонса, проникая в канальцы почек, повреждает их эпителий и забивает интерстиций, в результате чего происходит склерозирование стромы почки, приводя к почечной недостаточности.
Иммуноглобули́ны Y (IgY) — класс антител, имеющийся у птиц, рептилий и амфибий. IgY накапливаются в большом количестве в желтке яиц, куда транспортируются из плазмы крови. Молекула IgY состоит из двух тяжёлых и двух лёгких цепей. В ранних источниках IgY ошибочно именуют IgG из-за структурного и функционального сходства с иммуноглобулинами G млекопитающих. Однако между IgY и IgG всё же имеются существенные структурные и функциональные различия, а антитела, направленные против IgG (анти-IgG), не действуют на IgY.

Переключе́ние кла́ссов антите́л, или переключе́ние кла́ссов иммуноглобули́нов, или переключе́ние изоти́пов, — процесс переключения B-лимфоцита (B-клетки) с синтеза антител одного класса на синтез антител другого класса, например, с иммуноглобулинов M (IgM) на иммуноглобулины G (IgG). В ходе переключения классов константная часть локуса IGH, кодирующего тяжёлую цепь антител, претерпевает изменения, в то время как вариабельный участок остаётся неизменным. Так как вариабельный участок антитела не меняется, его антигенная специфичность остаётся прежней, и антитело продолжает распознавать тот же эпитоп.

Аллоти́п — вариация иммуноглобулина которая присутствует среди классов антител и проявляется гетерогенностью иммуноглобулинов, присутствующих у одного вида позвоночных. Структура полипептидной цепи иммуноглобулина диктуется и контролируется количеством генов, кодируемых в зародышевой линии. Однако эти гены, как было обнаружено серологическими и химическими методами, могут быть высоко полиморфными. Этот полиморфизм впоследствии проецируется на общую аминокислотную структуру цепей антител. Полиморфные эпитопы могут присутствовать в постоянных областях иммуноглобулина как на тяжелых, так и на легких цепях, различаясь между отдельными людьми или этническими группами и в некоторых случаях могут представлять собой иммуногенные детерминанты. Воздействие на людей несамостоятельного аллотипа может вызвать антиаллотипический ответ и стать причиной проблем, например, у пациента после переливания крови или у беременной женщины. Однако важно отметить, что не все вариации аминокислотной последовательности иммуноглобулина представляют собой детерминант, ответственный за иммунный ответ. Некоторые из этих аллотипических детерминант могут присутствовать в местах, которые не очень хорошо подвержены воздействию и поэтому вряд ли могут быть серологически различимы. В других случаях вариация одного изотипа может быть компенсирована присутствием этого детерминанта на другом изотипе антител у одного индивидуума. Это означает, что дивергентный аллотип тяжелой цепи IgG-антитела может быть сбалансирован присутствием этого аллотипа на тяжелой цепи, например, IgA-антитела и поэтому называется изоаллотипическим вариантом.особенно большое количество полиморфизмов было обнаружено в подклассах IgG-антител. Особенно большое количество полиморфизмов было обнаружено в подклассах IgG антител. Которые практически использовались в судебной медицине и в тестировании отцовства, прежде чем были заменены современной ДНК-дактилоскопией.

Йота-цепь иммуноглобулина — мембранный белок суперсемейства иммуноглобулинов. Продукт гена человека VPREB1.


















