Лёд
| Лёд | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Вода |
| Хим. формула | Н2O |
| Физические свойства | |
| Состояние | твёрдое тело |
| Молярная масса | 18,01528 г/моль |
| Плотность | 0,9167 г/см³ |
| Твёрдость | 1,5[1] |
| Термические свойства | |
| Температура | |
| • плавления | 0 °C |
| Тройная точка | 0,01 °C, 611,73 Па |
| Удельная теплота плавления | 3,3⋅105 Дж/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Лёд — вода в твёрдом агрегатном состоянии[2].
Льдом иногда называют некоторые вещества в твёрдом агрегатном состоянии, которым свойственно иметь жидкую или газообразную форму при комнатной температуре; в частности, сухой лёд, аммиачный лёд или метановый лёд.
Основные свойства водяного льда
В настоящее время известны три аморфных разновидности и 17 кристаллических модификаций льда. Фазовая диаграмма на рисунке справа показывает, при каких температурах и давлениях существуют некоторые из этих модификаций (более полное описание см. ниже).
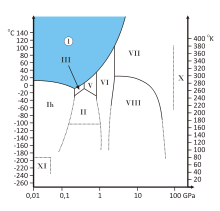
В природных условиях Земли вода образует кристаллы одной кристаллической модификации — гексагональной сингонии (лёд Ih). Во льду Ih каждая молекула Н2O окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от неё, равных 2,76 Å и размещённых в вершинах правильного тетраэдра.

Новые исследования формирования водяного льда на ровной поверхности меди при температурах от −173 °C до −133 °C показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры[3].
Ажурная кристаллическая структура такого льда приводит к тому, что его плотность, равная 916,7 кг/м³ при 0 °C, меньше плотности жидкой воды (999,8 кг/м³) при той же температуре. Поэтому вода, превращаясь в лёд, увеличивает свой объём примерно на 9%[4]. Лёд, будучи легче жидкой воды, образуется на поверхности водоёмов, что препятствует дальнейшему замерзанию воды.
Высокая удельная теплота плавления льда, равная 330 кДж/кг, (для сравнения: удельная теплотa плавления железа равна 270 кДж/кг), служит важным фактором в обороте тепла на Земле и любой подобной Земле планеты.
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем жидкая вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды (см. зонная плавка). Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа (например атмосферного воздуха). Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.

На суше
Общие запасы льда на Земле оцениваются в 30 млн км³. Основные запасы льда на Земле сосредоточены в полярных шапках (главным образом в Антарктической, где толщина слоя льда достигает 4 км, и Гренландской).
В океане
Вода в мировом океане солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и достаточно холодная для охлаждения морской воды до -3°С, либо вследствие малой глубины моря, расположенного в умеренном поясе. Различают однолетние и многолетние льды. Морской лёд может быть неподвижным, если спаян с сушей (припайный лёд) или плавучим, то есть дрейфующим. В океане встречаются льды, отколовшиеся от ледников суши и спустившиеся в океан в результате абляции — айсберги.
В космосе
Имеются данные о наличии льда на иных планетных телах Солнечной системы. В частности на Марсе также имеется водяной лёд. На ледяных спутниках газовых-гигантов, на ледяных-гигантах, ледяных карликовых планетах помимо водяного льда в больших количествах имеются и иные льды. Также из различных льдов состоят ядра комет.
Использование льда в технике

Ледяная гидросмесь. В конце 1980-х годов американская лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (ice slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения[5]. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут[5]. Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала пайкерит, из которого предлагалось сделать самый большой в мире авианосец. Использование льда для постройки искусственных островов описывается в фантастическом романе «Ледяной остров».


Структурные разновидности водяного льда
| Фаза | Характеристики[6][7] |
|---|---|
| Аморфный лёд | Аморфный лёд не обладает кристаллической структурой. Существует в трёх формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень высокой (сверхвысокой) плотности (VHDA), образующийся при высоких давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды («сверхохлаждённая стекловидная вода», HGW), или конденсацией водяного пара на очень холодной подложке («аморфная твёрдая вода», ASW), или путём нагрева высокоплотностных форм льда при нормальном давлении («LDA»). |
| Лёд Ih | Обычный гексагональный кристаллический лёд. Почти весь лёд на Земле относится к «Лёд Ih». (Только очень малая часть Земного льда есть «Лёд Ic.») |
| Лёд Ic | Метастабильный кубический кристаллический лёд. Атомы кислорода расположены в кристаллической решётке алмаза. Его получают при температуре в диапазоне от −133 °C до −123 °C, он остаётся устойчивым до −73 °C, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. |
| Лёд II | Тригональный кристаллический лёд с высокоупорядоченной структурой. Образуется изо льда Ih при сжатии и температурах от −83 °C до −63 °C. При нагреве он преобразуется в лёд III. |
| Лёд III | Тетрагональный кристаллический лёд. Формируется при охлаждении воды до −23 °C под давлением в 300 МПа. Его плотность больше, чем у воды, но он наименее плотный из всех разновидностей водяного льда в зоне высоких давлений. |
| Лёд IV | Метастабильный тригональный лёд. Его трудно получить без нуклеирующей затравки. |
| Лёд V | Моноклинный кристаллический лёд. Возникает при охлаждении воды до −20 °C под давлением в 500 МПа. Обладает самой сложной структурой в сравнении со всеми иными модификациями водяного льда. |
| Лёд VI | Тетрагональный кристаллический лёд. Образуется при охлаждении воды до −3 °C и под давлении в 1,1 ГПа. В нём проявляется дебаевская релаксация. |
| Лёд VII | Кубическая модификация. Нарушено расположение атомов водорода. Проявляется дебаевская релаксация. Водородные связи образуют две взаимопроникающие решётки. |
| Лёд VIII | Более упорядоченный вариант льда VII, где атомы водорода занимают, очевидно, фиксированные положения. Образуется изо льда VII при его охлаждении ниже 5 °C. |
| Лёд IX | Тетрагональная метастабильная модификация. Постепенно образуется изо льда III при его охлаждении от −65 °C до −108 °C. Стабилен при температурах ниже −133 °C и давлениях между 200 и 400 МПа. Его плотность 1,16 г/см³. (Т. е. несколько выше, чем у обычного льда.) |
| Лёд X | Симметричный лёд с упорядоченным расположением протонов. Образуется под давлением около 70 ГПа. |
| Лёд XI | Ромбическая низкотемпературная равновесная форма гексагонального льда. Сегнетоэлектрик. |
| Лёд XII | Тетрагональная метастабильная плотная кристаллическая модификация. Наблюдается в фазовом пространстве льда V и льда VI. Можно получить нагреванием аморфного льда высокой плотности от −196 °C до примерно −90 °C и под давлением в 810 МПа. |
| Лёд XIII | Моноклинная кристаллическая разновидность. Получается при охлаждении воды ниже −143 °C под давлением в 500 МПа. Разновидность льда V с упорядоченным расположением протонов. |
| Лёд XIV | Ромбическая кристаллическая разновидность. Получается при температуре ниже −155 °C под давлением в 1,2 ГПа. Разновидность льда XII с упорядоченным расположением протонов. |
| Лёд XV | Псевдоромбическая кристаллическая разновидность льда VI с упорядоченным расположением протонов. Можно получить путём медленного охлаждения льда VI примерно до −143 °C и давлении в 0,8-1,5 ГПа[8]. |
| Лёд XVI | Кристаллическая разновидность льда с наименьшей плотностью (0,81 г/см3)[9] среди всех экспериментально полученных форм льда. Имеет строение топологически эквивалентное полостной структуре КС-II (англ. sII) газовых гидратов. |
| Лёд XVII | Кристаллическая разновидность льда с меньшей кристаллографической плотностью (0,85 г/см3)[10], чем у других экспериментально полученных форм льда. Его структура, как и у льда XVI, сходна с клатратной структурой газовых гидратов. Получается при температуре 280 К и давлении ~ 400 МПа. Его номинальный состав (Н2О)2Н2 с тремя формульными единицами на элементарную ячейку. |
| Лёд XVIII | Лёд XVIII, так же известный как «суперионная вода». Представляет собой фазу воды, существующую при чрезвычайно высоких температурах и давлениях, при которых молекулы воды распадаются на ионы кислорода и водорода. Ионы кислорода кристаллизуются и формируют равномерно распределённую решётку, а ионы водорода свободно плавают по образовавшейся решётке из кислорода. |
| Лёд XIX | Лёд XIX это вторая упорядоченная форма льда VI. Возникает при медленном охлаждении воды до температуры 100 К при давлении около 2 ГПа[11]. |
Льды Арктики
 Дрейфующий лёд в Арктике
Дрейфующий лёд в Арктике- Лёд в период летней навигации
- Плотный лёд
 Ледяные поля
Ледяные поля- Атомоход «Ямал» ломает лёд
 Образование ниласа
Образование ниласа- Снежницы на ледяном поле
- Разлом льда
См. также
Примечания
- ↑ Петрушевский Ф. Ф., Гершун А. Л. Лед, в физике // Энциклопедический словарь — СПб.: Брокгауз — Ефрон, 1896. — Т. XVII. — С. 471—473.
- ↑ РМГ 75-2014. Измерения влажности веществ. Термины и определения, 2015, с. 1.
- ↑ A one-dimensional ice structure built from pentagons. Nature Materials. 8 March 2009 (англ.). Дата обращения: 18 апреля 2009. Архивировано 22 апреля 2009 года.
- ↑ Замерзающая вода выдавливает дно металлической ёмкости (видео). Дата обращения: 7 мая 2011. Архивировано 28 августа 2012 года.
- ↑ 1 2 Хирурги наполнят тела пациентов текущим льдом. Дата обращения: 29 декабря 2008. Архивировано из оригинала 28 апреля 2011 года.
- ↑ Фазы льда (англ.). Дата обращения: 5 февраля 2009. Архивировано из оригинала 25 марта 2009 года.
- ↑ Ледяные узоры высокого давления. Дата обращения: 6 февраля 2009. Архивировано из оригинала 18 февраля 2009 года.
- ↑ Впервые получен лёд XV. Дата обращения: 17 июня 2009. Архивировано 27 марта 2013 года.
- ↑ Andrzej Falenty, Thomas C. Hansen & Werner F. Kuhs. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — Vol. 516, P. 231—233 (11 December 2014) — Falenty Andrzej, Hansen Thomas C., Kuhs Werner F. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate // Nature. — 2014. — Декабрь (т. 516, № 7530). — С. 231—233. — ISSN 0028-0836. — doi:10.1038/nature14014.
- ↑ Timothy A. Strobel, Maddury Somayazulu, Stanislav V. Sinogeikin, Przemyslaw Dera & Russell J. Hemley. Hydrogen-stuffed, quartz-like water ice // Journal of the American Chemical Society[англ.]. — Vol. 138. — P. 13786-13789 (19 August 2016) — Strobel Timothy A., Somayazulu Maddury, Sinogeikin Stanislav V., Dera Przemyslaw, Hemley Russell J. Hydrogen-Stuffed, Quartz-like Water Ice // Journal of the American Chemical Society. — 2016. — 18 октября (т. 138, № 42). — С. 13786—13789. — ISSN 0002-7863. — doi:10.1021/jacs.6b06986..
- ↑ Structural characterization of ice XIX as the second polymorph related to ice VI | Nature Communications. Дата обращения: 30 марта 2021. Архивировано 22 марта 2021 года.
Литература
- Маэно Л. Наука о льде. М.: Мир, 1988.
- Рекомендации по межгосударственной стандартизации РМГ 75-2014. Государственная система обеспечения единства измерений. Измерения влажности веществ. Термины и определения. — М.: Стандартинформ, 2015. — iv + 16 с.
- Шавлов А. В. Лёд при структурных превращениях. Новосибирск: Наука, 1996.
Ссылки
- Вода, лед и снег. Физические, теплофизические, химические свойства. Инженерный справочник.
- Лёд Европы воссоздали на Земле
- Кристаллы снега и льда
- Арабаджи В. Загадки простой воды. Сооружения из льда
- Шавлов А. В., Рябцева А. А., Шавлова В. А. «Сверхскользкий лёд для конькобежного спорта» (2007)






















