Металлоцены

Металлоцены — органические соединения, образованные переходным металлом и циклопентадиеном.
Строение и свойства
Молекулы металлоценов имеют вид «сэндвича»: ион металла со степенью окисления +2 находится между двумя параллельными циклопентадиенильными кольцами на равном от них расстоянии. В большей части металлоценов металл связан с лигандами ковалентной связью, но в манганоцене химическая связь образуется за счёт электростатического взаимодействия катиона Mn2+ и анионов C5H5. В хромоцене и ванадоцене связь иона металла с лигандами также имеет частично ионный характер. Взаимное расположение циклопентадиенильных колец зависит от соединения: если в ферроцене эти кольца находятся в призматической или антипризматической конфигурации, то в рутеноцене и осмоцене — в призматической.
Металлоцены имеют интенсивную окраску и хорошо растворяются во многих органических растворителях. Способны возгоняться. Если ион металла в молекуле металлоцена имеет электронную оболочку как у благородных газов (например, в ферроцене, рутеноцене и осмоцене), то такие соединения являются довольно устойчивыми — выдерживают нагревание до 400 °C, не подвержены окислению на воздухе. Такие соединения обладают ароматическими свойствами: вступают в реакции электрофильного замещения (реакции сульфирования, ацилирования, меркурирования, металлирования). Менее устойчив никелоцен. Другие металлоцены неустойчивы на воздухе и быстро окисляются.
Металлоцены взаимодействуют с электроноакцепторными группами, образуя комплексы с переносом заряда. Они способны образовывать металлоцениевые катионы, устойчивые в кислых растворах, например: [(C5H5)2M]+ и образующие малорастворимые соединения с комплексными анионами [PF6]-, [BF4]-, [PtCl6]2-, [PhB4]-
Никелоцен способен обменивать свои циклопентадиенильные кольца на другие лиганды при взаимодействии с Ni(CO)4, NO, PPh3, KCN в среде жидкого аммиака, а также присоединять к непредельные соединения. Кобальтоцен окисляется водой с выделением молекулярного водорода и образованием кобальтоцениевого катиона [(C5H5)2Co]+, а с галогеноводородами образует соль кобальтоцения и устойчивые комплексные соединения:
Многие другие металлоцены неустойчивы к нагреванию и действию окислителей, чем напоминают карбены.
Получение и применение
Синтез металлоценов заключается в реакции циклопентадиенидов щелочных металлов, таллия или магния с солями или ацетилацетонатами переходных металлов, а также прямым взаимодействием циклопентадиена с солью или карбонилом переходного металла.
Металлоцены используются в качестве катализаторов и сокатализаторов в различных гомогенных реакциях, как лекарственные средства и присадки к топливам и маслам. Они также применяются как промежуточные реагенты в органическом синтезе.
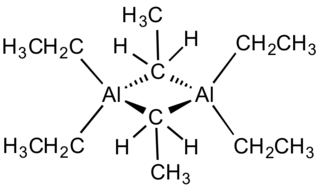
Диметаллоцены
Диметаллоцены — это молекулы, состоящие не из одного, а из двух ионов металла, окруженные углеродными кольцами. В 2004 году группа исследователей из Университета Севильи обнаружила диметаллоцен, включающий два атома цинка. В 2023 году в Британии синтезировали такую же молекулу, содержащую два атома бериллия.
В 2024 году ученые из Саарского университета (докторант Ига Бишофф и другие), под руководством доктора Андре Шефера получили первый в мире гетеробиметаллический диметаллоцен, в молекулу которого входит два разных металла — алюминий и литий. Молекулы этого вещества оказались весьма нестабильными в нормальных условиях и изучаются в атмосфере инертных газов[1].
Ссылки
- От медицины до энергетики: открыта чудо-молекула, которая может революционизировать современные технологии. www.securitylab.ru (7 сентября 2023). Дата обращения: 11 сентября 2023.
Литература
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
Примечания
- ↑ Химики синтезировали «бутербродную молекулу», предсказанную 20 лет назад. www.securitylab.ru (18 мая 2024). Дата обращения: 15 мая 2024. Архивировано 18 мая 2024 года.
![{\displaystyle {\mathsf {2[(C_{5}H_{5})_{2}Co]+CCl_{4}\rightarrow [(C_{5}H_{5})_{2}Co]Cl+\pi {\text{-}}[(C_{5}H_{5})_{2}Co]CCl_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b2a6233fb6ae8fb125bb1bb9e9ca6d9a540af5c)