Микротрубочки

Микротрубочки — белковые внутриклеточные структуры, входящие в состав цитоскелета.
Микротрубочки представляют собой полые цилиндры диаметром 25 нм. Длина их может быть от нескольких микрометров до, вероятно, нескольких миллиметров в аксонах нервных клеток. Их стенка образована димерами тубулина. Микротрубочки, подобно актиновым микрофиламентам, полярны: и сборка, и разборка микротрубочек происходят на обоих концах, однако скорость обоих процессов на "плюс" конце выше, чем на "минус" конце.[1] В клетках микротрубочки играют роль структурных компонентов и участвуют во многих клеточных процессах, включая митоз, цитокинез и везикулярный транспорт.
Строение
Микротрубочки — это структуры, в которых 13 протофиламентов[2], состоящих из гетеродимеров α- и β-тубулина, уложены по окружности полого цилиндра. Внешний диаметр цилиндра около 25 нм, внутренний — около 15.
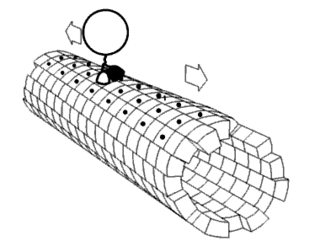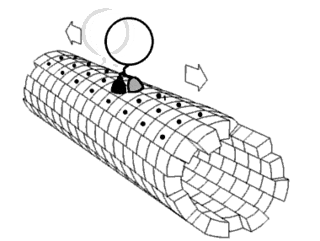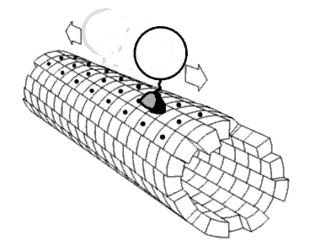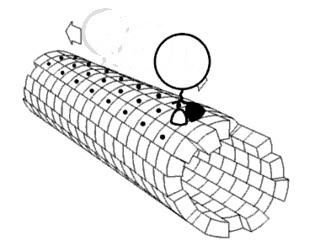
Один из концов микротрубочки, называемый плюс-концом, постоянно присоединяет к себе свободный тубулин. От противоположного конца — минус-конца — тубулиновые единицы отщепляются.

В образовании микротрубочки выделяют три фазы:
- Замедленная фаза, или нуклеация. Это этап зарождения микротрубочки, когда молекулы тубулина начинают соединяться в более крупные образования. Такое соединение происходит медленнее, чем присоединение тубулина к уже собранной микротрубочке, поэтому фаза и называется замедленной.
- Фаза полимеризации, или элонгация. Если концентрация свободного тубулина высока, его полимеризация происходит быстрее, чем деполимеризация на минус-конце, за счёт чего микротрубочка удлиняется. По мере её роста концентрация тубулина падает до критической, и скорость роста замедляется вплоть до вступления в следующую фазу.
- Фаза стабильного состояния. Деполимеризация уравновешивает полимеризацию, и рост микротрубочки останавливается.
Лабораторные исследования показывают, что сборка микротрубочек из тубулинов происходит только в присутствии гуанозинтрифосфата и ионов магния.
Динамическая нестабильность
Микротрубочки являются динамическими структурами и в клетке постоянно полимеризуются и деполимеризуются. Центросома, локализованная вблизи ядра, выступает в клетках животных и многих протистов как центр организации микротрубочек (ЦОМТ): они растут от неё к периферии клетки. В то же время микротрубочки могут внезапно прекратить свой рост и укоротиться обратно по направлению к центросоме вплоть до полного разрушения, а затем вырасти снова. При присоединении к микротрубочке молекулы тубулина, несущие ГТФ, образуют «шапочку», которая обеспечивает рост микротрубочки. Если локальная концентрация тубулина падает, связанная с бета-тубулином ГТФ постепенно гидролизуется. Если полностью гидролизуется ГТФ «шапочки» на +-конце, это приводит к быстрому распаду микротрубочки. Таким образом, сборка и разборка микротрубочек связана с затратами энергии ГТФ.
Динамическая нестабильность микротрубочек играет важную физиологическую роль. Например, при делении клетки микротрубочки растут очень быстро и способствуют правильной ориентации хромосом и образованию митотического веретена.
Функция
Микротрубочки в клетке используются в качестве «рельсов» для транспортировки частиц. По их поверхности могут перемещаться мембранные пузырьки и митохондрии. Транспортировку по микротрубочкам осуществляют белки, называемые моторными. Это высокомолекулярные соединения, состоящие из двух тяжёлых (массой около 300 кДа) и нескольких лёгких цепей. В тяжёлых цепях выделяют головной и хвостовой домены. Два головных домена связываются с микротрубочками и являются собственно двигателями, а хвостовые — связываются с органеллами и другими внутриклеточными образованиями, подлежащими транспортировке.
Выделяют два вида моторных белков:
Динеины перемещают груз только от плюс-конца к минус-концу микротрубочки, то есть из периферийных областей клетки к центросоме. Кинезины, напротив, перемещаются к плюс-концу, то есть к клеточной периферии.
Перемещение осуществляется за счёт энергии АТФ. Головные домены моторных белков для этого содержат АТФ-связывающие участки.
Помимо транспортной функции, микротрубочки формируют центральную структуру ресничек и жгутиков — аксонему. Типичная аксонема содержит 9 пар объединённых микротрубочек по периферии и две полных микротрубочки в центре. Из микротрубочек состоят также центриоли и веретено деления, обеспечивающее расхождение хромосом к полюсам клетки при митозе и мейозе. Микротрубочки участвуют в поддержании формы клетки и расположения органоидов (в частности, аппарата Гольджи) в цитоплазме клеток.
Растительные микротрубочки
Микротрубочки растений являются высокодинамическими составляющими цитоскелета, которые вовлечены в важные клеточные процессы, в частности, сегрегацию хромосом, формирование фрагмопласта, микрокомпартментализацию, внутриклеточный транспорт, а также в поддержание постоянной формы и полярности клетки. Мобильность микротрубочек обеспечивается динамической нестабильностью, передвижением полимеров моторными белками, тредмилингом[англ.]) и гибридным механизмом тредмилинга с динамической нестабильностью плюс-конца и медленной деполимеризацией минус-конца[3].
Организация и динамика

Микротрубочки чрезмерно чувствительны к биотическим и абиотическим факторам окружающей среды (холоду, освещению, засухе, засолению, влиянию гербицидов и пестицидов, затоплению, сжатию, воздействию электрического поля, давлению и силе тяжести), а также к фитогормонам, антимитотическим препаратам и ряду других биологически активных соединений[4]. Микротрубочки являются полыми полярными цилиндрическими филаментами диаметром свыше 24 нм, которые собираются из гетеродимеров α-и β-тубулина, которые в положении «голова-к-хвосту» формируют 13 протофиламентов.
Существенное ограничение иммуногистохимических исследований состоит в невозможности прижизненной визуализации динамики микротрубочек эукариотических и прокариотических клеток в режиме реального времени. Это ограничение было преодолено благодаря применению конфокальной микроскопии с зелёным флуоресцентным белком, изолированным из медузы Aequorea victoria L.[5]. Репортёрная конструкция GFP-MBD для гетерологической трансформации даже при низком уровне транзиентной экспрессии[6] in vivo и in vitro позволяет визуализировать динамическую нестабильность микротрубочек в разных типах клеток корня[7][8].
В клетках высших растений присутствуют четыре типа построений микротрубочек[9]:
- сетка кортикальных и эндоплазматических микротрубочек,
- препрофазная лента,
- митотическое веретено,
- фрагмопласт.
Белки, ассоциированные с микротрубочками
Все компоненты цитоскелета и другие органеллы связаны между собой рядом специфических белков, ассоциированных с микротрубочками (БАМ). В животных клетках наиболее исследованными БАМ является tau и БАМ2, которые стабилизируют микротрубочки и присоединяют их к другим клеточным структурам, а также транспортные белки динеин и кинезин[10]. Функционирование различных групп растительных микротрубочек зависит от наличия изоформ БАМ из семьи БАМ65 и регуляторных киназ и фосфатаз. В частности, высококонсервативный животный гомолог семьи БАМ65 важен для получения микротрубочками определенных конфигураций на протяжении развития растения[8]. Ориентация и организация различных популяций и типов построений микротрубочек является ткане- и органоспецифической[11].
Построение корня Резуховидки Таля (Arabidopsis thaliana L.) типично для двудольных растений. Ближайшим к поверхности корня является эпидермальный слой, клетки которого в зрелой зоне в зависимости от способности инициировать развитие корневых волосков являются трихобластами или атрихобластами[12]. Глубже расположены накопительный безхлоропластный кортикальный слой с многочисленными межклетниками и плазмодесмами и слой эндодермальных клеток с поясками Каспари на антиклинальных поверхностях[13]. Центральный цилиндр корня формируют паренхимные клетки перицикла[13], которые способны к быстрому делению, и элементы ксилемы и флоэмы. Присутствует и функциональное разграничение корневых зон: зоны деления, элонгации, созревания, а также переходная зона на границе зон инициации и элонгации. С перициклом формируются боковые корни, а с трихобластами эпидермального слоя — корневые волоски[13][14]. Кончик корня покрыт корневым чехликом со специфической морфологией клеток колумеллы.
Кортикальные микротрубочки
Ацентросомальные кортикальные микротрубочки (КМТ) важны для морфогенеза растений, регуляции клеточного деления и элонгации[15]. Высокодинамическая популяция мембраносвязанных коротких КМТ быстро реориентуется из интерфазного поперечного положения в продольное при элонгации клетки[16]. Ацентросомальные кортикальные микротрубочки имеют неупорядоченное размещение плюс-концов и обнаруживают динамическую нестабильность, а свободные минус-концы КМТ медленно деполимеризируются, то есть КМТ самоорганизуются гибридным механизмом динамической нестабильности и тредмилинга[3]. Энуклеация происходит по всей поверхности плазматической мембраны[3][16]. Белок SPR1 регулирует динамику и организацию плюс-конца КМТ растений, что сказывается на анизотропном росте клетки[17][18]. Ацентросомальные кортикальные микротрубочки располагаются параллельно целлюлозным микрофибриллам[19], правильная организация КМТ является существенной для нормального синтеза клеточной стенки[20]. Установлено, что КМТ объединяются в узлы, которые часто пересекаются для стабилизации микротрубочек и удержания белков на их поверхности[18].
Латеральные цилиндрические выросты трихобластов, корневые волоски, достигают значительной длины относительно собственной толщины с достаточно постоянным диаметром у Arabidopsis thaliana L. (незрелые ~ 6—10 нм; зрелые — более 1 мм) и характеризуются высокополярной цитоархитектурой[21]. Удлинение их происходит посредством верхушечного роста (англ. tip growth) путём поляризованного экзоцитоза, который отмечается возвратно-фонтанным током цитоплазмы, градиентом цитоплазматического Ca2+, активностью F-актина и смещением клеточного содержимого к верхушке волоска. На ранних стадиях развития корневые волоски 3-дневных проростков Arabidopsis thaliana L. растут со скоростью 0,4 мкм/мин, ускоряясь позже до 1—2,5 мкм/мин[21].
Растительным клеткам присуща организованная популяция кортикальных микротрубочек[10], которая в корневых волосках присутствует на всех уровнях развития[22][23]. При переходе из зачаточного состояния в состояние удлинения, кортикальные микротрубочки верхушки волосков не визуализируются, поскольку появляются эндоплазматические микротрубочки. Кортикальные микротрубочки ориентированы продольно или спирально[23][24]. У кукурузы (Zea mays L.) и латука посевного (Lactuca sativa L.) инициация роста корневых волосков связана с реорганизацией популяции КМТ в трихобластах[23][25][26]. Эта популяция контролирует стабильность и направление апикального роста корневых волосков[27][28]. Сравнение четырех стандартных параметров динамической нестабильности КМТ in vivo — уровня ростовой активности, скорости разборки, частоты переходов от разборки к росту («спасение») и наоборот («катастрофа») выявило, что кортикальные микротрубочки (КМТ) молодых корневых волосков являются динамичными, потому что зрелые. Сетка микротрубочек реорганизуется в ответ на меняющиеся параметры окружающей среды и стимулы дифференциации путём варьирования показателей динамической нестабильности[28].
См. также
Примечания
- ↑ Molecular biology of the cell. Hauptbd. / Bruce Alberts. — 5. ed., reference ed. — New York, NY: Garland Science Taylor & Francis, 2008. — 1601 с. — ISBN 978-0-8153-4111-6.
- ↑ Протофиламе́нт (от др. греч. πρώτος «первый» и англ. filament «нить») - субъединица 2-3 нм диаметром, участвует в создании промежуточных филаментов. Формируется из антипараллельных тетрамер с амино- и карбоновых групп на концах, и, является структурной составляющей микротрубочек. B. Alberts, A. Johnson, D. Lewis, et al. - Molecular biology of the cell, 2012.
- ↑ 1 2 3 Shaw et al., 2003.
- ↑ Weber and Westermann, 2003.
- ↑ Ueda, 1999.
- ↑ Транзиентная экспрессия (от лат. transitus — переход, прохождение и expressio — выражение) — непродолжительная (временная) экспрессия клонированного гена, введенного в непермиссивную клеточную систему с помощью трансфекции и не интегрированного с геномом клетки-хозяина.
- ↑ Marc et al., 1998.
- ↑ 1 2 Wasteneys and Yang, 2004.
- ↑ Barlow and Balushka, 2000.
- ↑ 1 2 Goddard et al., 1994.
- ↑ Lloyd, 1994.
- ↑ Sugimoto et al., 2000.
- ↑ 1 2 3 Dolan et al., 1993.
- ↑ Рейвн и др., 1990.
- ↑ Dixit et al., 2006.
- ↑ 1 2 Yuan et al., 1994.
- ↑ Dixit and Cyr , 2004.
- ↑ 1 2 Lloyd., 1994.
- ↑ Baskin et al., 2004.
- ↑ Burk et al., 2006.
- ↑ 1 2 Dolan et al., 1994.
- ↑ Sieberer et al., 2002.
- ↑ 1 2 3 Van Bruaene et al., 2004.
- ↑ Sieberer et al., 2005
- ↑ Balusˇka et al., 2000.
- ↑ Geitmann and Emons, 2000.
- ↑ Bibikova et al., 1999.
- ↑ 1 2 Vassileva et al., 2005.
Литература
- Дж. М. Фаллер, Д. Шилдс. Молекулярная биология клетки. Руководство для врачей. Пер. с англ. — М.: «БИНОМ», 2006. — 256 с.