Миоциты
| Мышечная клетка | |
|---|---|
 Общая структура клетки скелетной мышцы и нервно-мышечного соединения: 1 — аксон; 2 — нервно-мышечный синапс; 3 — мышечная клетка (миоцит); 4 — миофибрилла | |
Миоци́ты (от др.-греч. μῦς — «мышца» + др.-греч. κύτος — «клетка»), или мы́шечные клетки — особый тип клеток, составляющий основную часть мышечной ткани. Миоциты представляют собой длинные, вытянутые клетки, развивающиеся из клеток-предшественников — миобластов[1].
Классификация
Существует несколько типов миоцитов:
- миоциты поперечнополосатой мускулатуры
- гладкой мускулатуры.
Каждый из этих типов обладает особыми свойствами и морфологией. Например, кардиомиоциты, помимо прочего, генерируют электрические импульсы, задающие сердечный ритм (то есть обладают автоматизмом).
Морфология
Необычная микроскопическая анатомия мышечной клетки породила собственную терминологию. Цитоплазмы в клетках мышц называются саркоплазмой, гладкая эндоплазматическая сеть из мышечной клетки называется саркоплазматический ретикулум, а клеточная мембрана в мышечной клетке называется сарколеммой[2]
Терминология
В связи с крайне необычным строением мышечной клетки для её описания цитологами была создана специальная терминология. Каждому из особых терминов, относящихся к мышечной клетке, соответствует аналог, использующийся для описания обычных клеток.
| Мышечная клетка | Другие клетки |
| саркоплазма | цитоплазма |
| саркоплазматический ретикулум | гладкий эндоплазматический ретикулум |
| саркосома | митохондрия |
| сарколемма | клеточная мембрана, или плазматическая мембрана |
Клетки гладкой мускулатуры

Гладкомышечные клетки называются так, потому что у них нет ни миофибрилл, ни саркомеров, и, следовательно, нет «полос». Они обнаруживаются в стенках полых органов, включая желудок, кишечник , мочевой пузырь и матку, в стенках кровеносных сосудов, а также в путях дыхательной, мочевыделительной и репродуктивной систем. В глазах цилиарная мышца расширяется и изменяет форму хрусталика. В коже гладкомышечные клетки волосяного фолликула заставляют волосы встать дыбом в ответ на холод или страх.[3]
Гладкомышечные клетки имеют веретенообразную форму с широкими серединами и сужающимися концами. Они имеют одно ядро и имеют длину от 30 до 200 микрометров. Это многократно короче волокон скелетных мышц. Диаметр также намного меньше, что устраняет необходимость в Т-канальцах, обнаруженных в поперечно-полосатых мышечных клетках. Хотя в гладкомышечных клетках отсутствуют саркомеры и миофибриллы, они содержат большое количество сократительных белков актина и миозина. Нити актина прикреплены плотными телами (подобными Z-дискам в саркомерах) к сарколемме.[3]
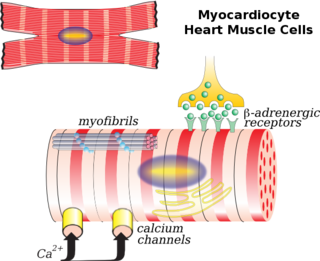
Кардиомиоциты

Сердечная мышца, такая как скелетная мышца, также имеет поперечно-полосатую форму, а клетки содержат миофибриллы, миофиламенты и саркомеры в качестве клеток скелетных мышц. Клеточная мембрана прикреплена к цитоскелету клетки якорными волокнами шириной примерно 10 нм. Обычно они располагаются на Z-линиях, так что образуют бороздки и выходят поперечные канальцы. В сердечных миоцитах это образует зубчатую поверхность[4].
Скелетная поперечнополосатая

Одна мышца, такая как двуглавая мышца плеча у молодого взрослого мужчины, содержит около 253 000 мышечных волокон[5]. Мышечные волокна скелетной мускулатуры имеют синцитиальное происхождение из отдельных клеток миобластов, сливающихся в миотрубочки во время миогенеза[6]. После слияния диаметр волокна — цилиндрического многоядерного образования — поперечнополосатых мышц составляет от 5 до 100 мкм, а длина может достигать нескольких сантиметров и более. Каждое мышечное волокно состоит из расположенных параллельно миофибрилл, состоящих из длинных белковых цепей миофиламентов, которые включают в себя повторяющиеся в продольном направлении блоки — саркомеры, отделенные друг от друга Z-пластинками. Существует три типа миофиламентов: тонкие, толстые и эластичные, которые работают вместе, вызывая сокращение мышц[7]. Тонкие миофиламенты состоят в основном из актина, а толстые — из миозина, и они скользят друг по другу, сокращая длину волокна при сокращении мышц. Третий тип миофиламентов — это эластичные волокна, состоящие из очень большого белка титина.
В поперечнополосатой мышечной ткани миозин образует темные нити, которые составляют группу A. Тонкие нити актина являются легкими нитями, которые составляют I группы. Самая маленькая сократительная единица в волокне называется саркомером, которая представляет собой повторяющуюся единицу в пределах двух Z-полос. Саркоплазма также содержит гликоген, который обеспечивает клетку энергией во время интенсивных упражнений, и миоглобин, красный пигмент, который сохраняет кислород до тех пор, пока он не понадобится для мышечной активности[7]
Саркоплазматический ретикулум, специализированный тип гладкой эндоплазматической сети, образует сеть вокруг каждой миофибриллы мышечного волокна. Эта сеть состоит из групп двух расширенных концевых мешочков, называемых терминальными цистернами, и одного Т-канальца (поперечного канальца), который проходит через клетку и выходит на другую сторону; вместе эти три компонента образуют триады, которые существуют в сети саркоплазматического ретикулума, в котором каждый Т-каналец имеет две терминальные цистерны с каждой стороны. Саркоплазматический ретикулум служит резервуаром для ионов кальция, поэтому, когда потенциал действия распространяется по Т-канальцу, он дает сигнал саркоплазматическому ретикулуму высвободить ионы кальция из закрытых мембранных каналов, чтобы стимулировать сокращение мышц.[7][8] В скелетных мышцах на конце каждого мышечного волокна внешний слой сарколеммы соединяется с сухожильными волокнами в мышечно-сухожильном соединении[9][10]
Каждое скелетное мышечное волокно отдельно иннервируется возбуждающим моторным аксоном.[11]
Развитие
Миобласт — это эмбриональная клетка-предшественник, которая дифференцируется, давая начало различным типам мышечных клеток[12]. Дифференцировка регулируется миогенными регуляторными факторами, включая MyoD, Myf5, миогенин и MRF4[13]. GATA4 и GATA6 также играют роль в дифференцировке миоцитов[14].
Скелетные мышечные волокна образуются, когда миобласты сливаются вместе; следовательно, мышечные волокна представляют собой клетки с несколькими ядрами, известными как мионуклеусы, причем каждое клеточное ядро происходит из одного миобласта. Слияние миобластов специфично для скелетных мышц, а не для сердечной мышцы или гладкой мускулатуры.
Миобласты в скелетных мышцах, которые не образуют мышечных волокон, дедифференцируются обратно в миосателлитные клетки. Эти сателлитные клетки остаются смежными со скелетным мышечным волокном, расположенным между сарколеммой и базальной мембраной[15] эндомизия (соединительной тканью, которая разделяет мышечные пучки на отдельные волокна). Чтобы повторно активировать миогенез, необходимо стимулировать клетки-сателлиты для дифференцировки в новые волокна.
Миобласты и их производные, включая сателлитные клетки, теперь могут быть получены in vitro путем направленной дифференцировки плюрипотентных стволовых клеток[16].
Киндлин-2 играет роль в развитии удлинения во время миогенеза[17].
Функция
При сокращении тонкие и толстые нити скользят друг относительно друга за счет аденозинтрифосфата. Это сближает Z-диски друг с другом в процессе, называемом механизмом скользящей нити. Сокращение всех саркомеров приводит к сокращению всего мышечного волокна. Это сокращение миоцита запускается потенциалом действия над клеточной мембраной миоцита. Потенциал действия использует поперечные канальцы, чтобы попасть с поверхности внутрь миоцита, который непрерывно находится внутри клеточной мембраны. Саркоплазматические ретикулумы представляют собой перепончатые мешки, которые соприкасаются поперечными канальцами, но остаются отдельными от них. Они обертываются вокруг каждого саркомера и наполнены Ca2+[18].
Сокращение сердечной мышцы
Специализированные кардиомиоциты в синоатриальном узле генерируют электрические импульсы, контролирующие частоту сердечных сокращений. Эти электрические импульсы координируют сокращение остальной сердечной мышцы через систему пейсмейкеров сердца. Активность синоатриального узла, в свою очередь, модулируется нервными волокнами как симпатической, так и парасимпатической нервной системы. Эти системы действуют, увеличивая и уменьшая, соответственно, скорость производства электрических импульсов синоатриальным узлом.
Эволюция
Эволюционное происхождение мышечных клеток животных дискуссионно. Согласно одной точке зрения, мышечные клетки эволюционировали один раз, и поэтому все мышечные клетки имеют одного общего предка. Другая точка зрения состоит в том, что мышечные клетки эволюционировали более одного раза, и любое морфологическое или структурное сходство связано с конвергентной эволюцией и генами, предшествовавшими эволюции мышц и даже мезодермы — зародышевого слоя, дающего начало мышечным клеткам позвоночных.
Шмид и Зайпель утверждают, что происхождение мышечных клеток — это монофилетическая черта, которая возникла одновременно с развитием пищеварительной и нервной систем всех животных, и что это происхождение можно проследить до единственного предка многоклеточных животных, в котором присутствуют мышечные клетки. Они утверждают, что молекулярные и морфологические сходства между мышечными клетками у cnidaria и ctenophora достаточно похожи на таковые у bilaterians, чтобы у многоклеточных животных был один предок, от которого произошли мышечные клетки. В этом случае Шмид и Зайпель утверждают, что последним общим предком bilateria, ctenophora и cnidaria был триплобласт или организм с тремя зародышевыми листками, и это, что означает организм с двумя зародышевыми листками, который эволюционировал вторично из-за их «наблюдения» за отсутствием мезодермы или мышц, обнаруживаемых у большинства книдарий и гребневиков. Сравнивая морфологию книдарий и гребневиков с билатериями, Шмид и Зайпель смогли сделать вывод о наличии миобластоподобных структур в щупальцах и кишечнике некоторых видов книдарий, а также в щупальцах гребневиков. Поскольку это уникальная структура мышечных клеток, эти ученые определили на основе данных, собранных их сверстниками, что это маркер поперечно-полосатых мышц, аналогичный тому, который наблюдается у билатерий. Авторы также отмечают, что мышечные клетки, обнаруженные у книдарий и гребневиков, часто являются конкурирующими из-за происхождения этих мышечных клеток, являющихся эктодермой, а не мезодерма или мезендодерма. Другие утверждают, что происхождение настоящих мышечных клеток — это часть энтодермы, мезодермы и энтодерма. Однако Шмид и Зайпель опровергают этот скептицизм относительно того, являются ли мышечные клетки гребневиков и книдарий истинными мышечными клетками, учитывая, что книдарии развиваются через стадию медузы и стадию полипа. Они наблюдают, что на стадии Hydrozoan medusa существует слой клеток, который отделяется от дистальной стороны эктодермы, чтобы сформировать поперечно-полосатые мышечные клетки, что кажется сходным с таковым в мезодерме, и называют этот третий отделенный слой клеток эктокодоном. . Они также утверждают, что не все мышечные клетки происходят из мезендодермы у билатерий, ключевыми примерами являются то, что как в глазных мышцах позвоночных, так и в мышцах спиралиев эти клетки происходят из эктодермальной мезодермы, а не из энтодермальной мезодермы[19].
Эволюционно специализированные формы скелетных и сердечных мышц предшествовали дивергенции эволюционной линии позвоночных / членистоногих[20] Это указывает на то, что эти типы мышц развились у общего предка примерно 700 миллионов лет назад (млн лет назад) . Было обнаружено, что гладкие мышцы позвоночных развивались независимо от типов скелетных и сердечных мышц.
Примечания
- ↑ MeSH Myocytes
- ↑ Saladin, Kenneth S. Human anatomy. — 3rd. — New York : McGraw-Hill, 2011. — P. 244–246. — ISBN 9780071222075.
- ↑ 1 2 Betts, J. Gordon; Young, Kelly A.; Wise, James A.; Johnson, Eddie; Poe, Brandon; Kruse, Dean H.; Korol, Oksana; Johnson, Jody E.; Womble, Mark; Desaix, Peter (6 March 2013). "Smooth muscle". Архивировано 7 октября 2021. Дата обращения: 10 июня 2021.
{{cite journal}}: Cite journal требует|journal=() - ↑ Ferrari, Roberto Healthy versus sick myocytes: metabolism, structure and function. oxfordjournals.org/en. Oxford University Press. Дата обращения: 12 февраля 2015. Архивировано из оригинала 19 февраля 2015 года.
- ↑ Klein, CS; Marsh, GD; Petrella, RJ; Rice, CL (July 2003). "Muscle fiber number in the biceps brachii muscle of young and old men". Muscle & Nerve. 28 (1): 62—8. doi:10.1002/mus.10386. PMID 12811774. S2CID 20508198.
- ↑ Cho, CH; Lee, KJ; Lee, EH (August 2018). "With the greatest care, stromal interaction molecule (STIM) proteins verify what skeletal muscle is doing". BMB Reports. 51 (8): 378—387. doi:10.5483/bmbrep.2018.51.8.128. PMC 6130827. PMID 29898810.
- ↑ 1 2 3 Saladin, K. Anatomy & Physiology: The Unity of Form and Function. — 6th. — New York : McGraw-Hill, 2012. — P. 403–405. — ISBN 978-0-07-337825-1.
- ↑ Sugi, Haruo; Abe, T; Kobayashi, T; Chaen, S; Ohnuki, Y; Saeki, Y; Sugiura, S; Guerrero-Hernandez, Agustin (2013). "Enhancement of force generated by individual myosin heads in skinned rabbit psoas muscle fibers at low ionic strength". PLOS ONE. 8 (5): e63658. Bibcode:2013PLoSO...863658S. doi:10.1371/journal.pone.0063658. PMC 3655179. PMID 23691080.
- ↑ Charvet, B; Ruggiero, F; Le Guellec, D (April 2012). "The development of the myotendinous junction. A review". Muscles, Ligaments and Tendons Journal. 2 (2): 53—63. PMC 3666507. PMID 23738275.
- ↑ Bentzinger, CF; Wang, YX; Rudnicki, MA (1 February 2012). "Building muscle: molecular regulation of myogenesis". Cold Spring Harbor Perspectives in Biology. 4 (2): a008342. doi:10.1101/cshperspect.a008342. PMC 3281568. PMID 22300977.
- ↑ Роджер Эккерт, Дейвид Рэнделл, Джордж Огастин. Физиология животных. Механизмы и адаптация / под ред. Т.М. Турпаева. — М.: Мир, 1991. — С. 411.
- ↑ page 395, Biology, Fifth Edition, Campbell, 1999
- ↑ Perry R, Rudnick M (2000). "Molecular mechanisms regulating myogenic determination and differentiation". Front Biosci. 5: D750—67. doi:10.2741/Perry. PMID 10966875.
- ↑ Zhao R, Watt AJ, Battle MA, Li J, Bondow BJ, Duncan SA (May 2008). "Loss of both GATA4 and GATA6 blocks cardiac myocyte differentiation and results in acardia in mice". Dev. Biol. 317 (2): 614—9. doi:10.1016/j.ydbio.2008.03.013. PMC 2423416. PMID 18400219.
- ↑ Zammit, PS; Partridge, TA; Yablonka-Reuveni, Z (November 2006). "The skeletal muscle satellite cell: the stem cell that came in from the cold". Journal of Histochemistry and Cytochemistry. 54 (11): 1177—91. doi:10.1369/jhc.6r6995.2006. PMID 16899758.
- ↑ Chal J, Oginuma M, Al Tanoury Z, Gobert B, Sumara O, Hick A, Bousson F, Zidouni Y, Mursch C, Moncuquet P, Tassy O, Vincent S, Miyanari A, Bera A, Garnier JM, Guevara G, Hestin M, Kennedy L, Hayashi S, Drayton B, Cherrier T, Gayraud-Morel B, Gussoni E, Relaix F, Tajbakhsh S, Pourquié O (August 2015). "Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy". Nature Biotechnology. 33 (9): 962—9. doi:10.1038/nbt.3297. PMID 26237517. S2CID 21241434. Архивировано 22 апреля 2022. Дата обращения: 29 августа 2022.

- ↑ Dowling JJ, Vreede AP, Kim S, Golden J, Feldman EL (2008). "Kindlin-2 is required for myocyte elongation and is essential for myogenesis". BMC Cell Biol. 9: 36. doi:10.1186/1471-2121-9-36. PMC 2478659. PMID 18611274.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Structure and Function of Skeletal Muscles. courses.washington.edu. Дата обращения: 13 февраля 2015. Архивировано 15 февраля 2015 года.
- ↑ Seipel, Katja; Schmid, Volker (1 June 2005). "Evolution of striated muscle: Jellyfish and the origin of triploblasty". Developmental Biology. 282 (1): 14—26. doi:10.1016/j.ydbio.2005.03.032. PMID 15936326.
- ↑ OOta, S.; Saitou, N. (1999). "Phylogenetic relationship of muscle tissues deduced from superimposition of gene trees". Molecular Biology and Evolution. 16 (6): 856—867. doi:10.1093/oxfordjournals.molbev.a026170. ISSN 0737-4038. PMID 10368962.