Ква́нтовая хи́мия — направление теоретической химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др. Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне. Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближенные методы расчета. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для создания специальных компьютерных программ, используемых для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции взаимодействия молекул.

Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Характерными примерами таких электроотрицательных атомов являются атомы элементов второго периода периодической системы — азота, кислорода и фтора, а также атомы некоторых других элементов с высокой относительно водорода электроотрицательностью. Водородные связи могут быть межмолекулярными или внутримолекулярными.
Химическая связь — взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи — прочность, длина, полярность, устойчивость.

Ионная связь — сильная химическая связь между атомами существенно отличающимися между собой по электроотрицательности.

Теория молекулярных орбиталей (МО) даёт представление о распределении электронной плотности и объясняет свойства молекул.
Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т. д.

Ковале́нтная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.

Свободные радикалы в химии — частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Свободные радикалы бывают твёрдыми, жидкими и газообразными веществами и могут существовать от очень короткого до очень долгого времени. Радикалы могут быть не только нейтральными, но и ионными, а также иметь более одного неспаренного электрона. Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.
А́том водоро́да — физико-химическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра, как правило, входит протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон образует электронную оболочку; наибольшая вероятность обнаружения электрона в единичном объёме наблюдается для центра атома. Интегрирование по сферическому слою показывает, что наибольшая вероятность обнаружения электрона в единичном слое соответствует среднему радиусу, равному боровскому радиусу  ангстрема.
ангстрема.
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме вторичной изотопной модификации H2, имеет разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
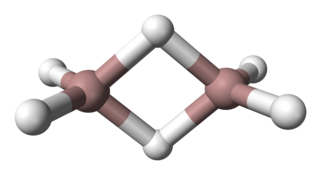
Дигалла́н, или гидрид галлия(III), — неорганическое бинарное химическое соединение галлия и водорода. Химическая формула — Ga2H6.
Одноэлектронная химическая связь — это простейшая химическая связь, обуславливающая существование молекулярных соединений посредством кулоновского удерживания двух атомных ядер одним электроном. Главные отличительные черты одноэлектронной химической связи — это понижение полной энергии молекулярной системы по сравнению с энергией изолированных атомов и атомных фрагментов, из которых она образована, а также существенное перераспределение электронной плотности в области одноэлектронной химической связи по сравнению с простым наложением электронной плотности атома и атомного фрагмента, сближенных на расстоянии связи.
Электронная поляризуемость — это смещение электронной плотности в атомах, молекулах, ионах относительно атомных ядер частиц под действием внешнего электрического поля напряжённостью E. Смещение электронной плотности приводит к образованию наведённого электрического дипольного момента μ, который равен произведению величины положительного заряда q на расстояние между зарядами L и направлен от отрицательного заряда к положительному μ=qL

Помимо модели атома, Нильс Бор предложил также и модель химической связи.

Теория изогнутой химической связи предложена Лайнусом Полингом на симпозиуме по теоретической органической химии, посвящённом памяти А. Кекуле. В докладе Полинга дана теория двойной связи как комбинации двух одинаковых изогнутых связей. Изгиб химической связи вызван электростатическим отталкиванием электронов, образующих химическую связь. Под действием кулоновских сил отталкивания электронов, происходит смещение последних с линии, соединяющих ядра молекулы. Полинг отмечал, что описание двойной и тройной связи с помощью представления об изогнутых связях поразительным образом объясняет некоторые из их свойств. Так, если кратные связи имеют вид дуг длиной 1,54 Å и начальное направление их совпадает с тетраэдрическим, то их вычисленная длина оказывается равной 1,32 Å для двойной связи и 1,18 Å для тройной, что хорошо соответствует экспериментальным значениям 1,33 и 1,20 Å. На этом симпозиуме Полинг со всей категоричностью утверждал: «Могут найтись химики, полагающие, что чрезвычайно важным новшеством явилось введение σ, π-описания для двойной или тройной связи и сопряжённых систем вместо описания с помощью изогнутых связей. Я же утверждаю, что σ, π-описание менее удовлетворительно, чем описание с помощью изогнутых связей, что это нововведение является только переходящим и вскоре отомрёт.» Полинг оказался прав, теория валентных связей, в которой использовались σ, π-описания химической связи, потеряла своё лидирующее положение.

Теория валентных связей — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.

Электронная теория химической связи была предложена и развита американским физикохимиком Льюисом Г.Н в 1912—1916 гг. Ковалентная химическая связь, по Льюису, образуется за счёт обобществления пары электронов, то есть электронная плотность распределяется между двумя атомами, в противовес господствующей в то время теории, будто один из связанных атомов несёт положительный, а другой отрицательный заряд. Льюис также предложил обозначать электроны точками у символа химического элемента. Электронная теория химической связи включает идею Льюиса, что завершённый внешний электронный слой атома содержит восемь электронов.

Гидрид-ион, отрицательно заряженный ион водорода, H- — физическая система, состоящая из одного протона и двух электронов. Два электрона создают электронную оболочку гидрид-иона, электронная конфигурация которой 1s2. Иначе говоря, ядро гидрид-иона окружает двухэлектронное облако с антипараллельными спинами электронов. Образование гидрид-иона описывается физической моделью ударной ионизации атома водорода электроном. Ионизация обусловлена захватом атомом водорода дополнительного электрона с образованием отрицательно заряженного иона водорода и высвобождением энергии:

Электронная пара — связанное состояние двух взаимодействующих электронов. Обладает нулевым спином и зарядом, равным удвоенному заряду электрона.
До́норно-акце́пторное взаимоде́йствие — перенос заряда между молекулами донора и акцептора без образования между ними химической связи ; или передача неподеленной электронной пары от донора к акцептору, приводящая к образованию связи.



![{\displaystyle {\mathsf {H_{2}^{+}+H_{2}\rightarrow [H_{4}^{+}]^{*}\rightarrow H_{3}^{+}+H+1,1\ eV}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fab70f6539ec29a4c795eaeb544c98496e527f8e)











