Надпероксид калия
| Надпероксид калия | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | Надпероксид калия | ||
| Традиционные названия | диоксид калия, супероксид калия, гипероксид калия, надперекись калия | ||
| Хим. формула | KO2 | ||
| Физические свойства | |||
| Молярная масса | 71,10 г/моль | ||
| Плотность | 2,158 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 535 °C | ||
| Энтальпия | |||
| • образования | −280 кДж/моль | ||
| Структура | |||
| Кристаллическая структура | Тетрагональная сингония, ячейка типа CaC2 | ||
| Классификация | |||
| Рег. номер CAS | 12030-88-5 | ||
| PubChem | 61541 | ||
| Рег. номер EINECS | 234-746-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | TT6053000 | ||
| ChemSpider | 28638468 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Надперокси́д ка́лия (диоксид калия, супероксид калия; KO2) — неорганическое соединение жёлтого цвета, которое образуется в результате сгорания расплавленного калия в чистом кислороде. Используется наряду с надпероксидом натрия во многих системах жизнеобеспечения, в кислородных масках на пассажирских самолётах, а также в изолирующих противогазах. Молекулярная масса 71,10. Температура плавления при нормальном атмосферном давлении 490—530 °C, в вакууме (1—2 мм рт. ст.) 350—415 °C. Гигроскопичен, поглощает из воздуха водяные пары и углекислый газ, выделяет кислород, реагируя с углекислым газом. Реагирует с водой и этанолом. Плотность 2,158 г/см³. Реакция с водой очень бурная, экзотермическая, может происходить со взрывом, поэтому недопустим контакт вещества или изделий, содержащих его (регенеративные патроны) с водой.
Получение
Простой способ получения состоит в сгорании калия в чистом кислороде:
При этом продукт загрязнён примесью K2O2.
К экзотическим можно отнести способ окисления кислородом раствора калия в жидком аммиаке при ≈ −50 °C:
при этом состав зависит от температуры проведения реакции — чем она выше, тем большая степень окисления.
Физические свойства
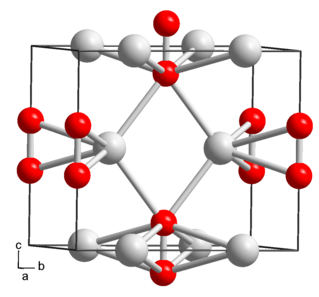
Оранжево-жёлтые кристаллы тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,570 нм, b = 0,672 нм, Z = 4, упаковка типа CaC2.
Температура плавления 535 °C под избыточным давлением кислорода.
Раньше надпероксиду калия приписывали формулу K2O4, однако рентгенографические исследования структуры показали, что вещество состоит из ионов K+ и O−
2, что соответствует формуле KO2[1].
Химические свойства
Надпероксид калия неустойчив и при нагревании в вакууме отщепляет кислород:
Вода разлагает надпероксид калия с выделением кислорода:
Разбавленные кислоты разлагают надпероксид калия на пероксид водорода и кислород:
С концентрированной серной кислотой выделяется озон:
Надпероксид калия является сильным окислителем:
Наиболее важной, в практическом применении, является реакция с углекислым газом:
Эта реакция используется в изолирующих противогазах для очистки выдыхаемого воздуха.
С помощью краун-эфиров надпероксид калия удалось растворить в органических растворителях и использовать для окисления органических веществ.
Применение
Промышленность
Надпероксид калия используется в химической промышленности как мощный окислитель, а также для удаления следов углекислого газа CO2 и воды H2O.
Космонавтика и системы жизнеобеспечения
Надпероксид калия применяется в российской космонавтике в качестве источника кислорода и поглотителя углекислого газа. В частности он применяется на российских космических кораблях «Союз» и в специальных костюмах для выхода в открытый космос. Используется также в средствах химзащиты для автономной генерации кислорода и во многих системах жизнеобеспечения (например, в аппаратах для глубоководного погружения, шахтных самоспасателях). Килограмм надпероксида калия может поглотить 0,309 кг CO2 с выделением 0,38 кг кислорода.
Подводные лодки
Также применяется в качестве резервного источника кислорода и поглотителя углекислого газа на подлодках и субмаринах (например, на минисубмарине «Приз»).
Биология
В результате реакции надпероксида калия с водой выделяется кислород. Однако промежуточным продуктом этой реакции в воде является супероксидный радикал — начальный компонент клеточного оксидативного стресса, поэтому надпероксид калия может использоваться в качестве неферментативного источника надпероксида (в отличие от ферментативного образования надпероксида, катализируемого, например ксантиноксидазой) для модельного оксидативного стресса.
См. также
Ссылки
- Superoxide chemistry by Donald T.Sawyer
- Статья: Реакция супероксида калия с морской водой
- Супероксид калия: плавление (недоступная ссылка)
Примечания
- ↑ Реми Г. Курс неорганической химии. — М.: Изд. иностр. лит., 1963. — 921 с.