Окрелизумаб
| Окрелизумаб | |
|---|---|
| Химическое соединение | |
| Брутто-формула | C6494H9978N1718O2014S46 |
| Молярная масса | 148 kDa |
| CAS | 637334-45-3 |
| DrugBank | DB11988 |
| Состав | |
| Моноклональное антитело | |
| Организм-источник | zu/o |
| Мишень | CD20 |
| Классификация | |
| АТХ | L04AA36 |
| Способы введения | |
| внутривенная инфузия | |
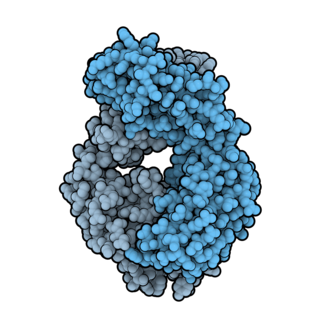
Окрелизумаб — гуманизированное анти-CD20 моноклональное антитело. Оно поражает зрелые B-лимфоциты[1] и тем самым является иммунодепрессантом. Оно находится в совместной разработке компаний Genentech и Biogen, являющихся субсидиарами компании Hoffmann-La Roche.
Окрелизумаб достиг фазы III клинических испытаний для ревматоидного артрита[2] и системной красной волчанки,[3] а также фазы II для рассеянного склероза (РС)[4] и лимфом[5].
В марте 2010, Hoffmann-La Roche анонсировала досрочное прекращение клинических испытаний окрелизумаба при ревматоидном артрите и системной красной волчанке. Этот шаг последовал за сообщениями о повышенной смертности больных с этими заболеваниями, получавших окрелизумаб, от оппортунистических инфекций. Однако разработка окрелизумаба как средства лечения рассеянного склероза продолжилась, поскольку среди этих больных повышенной смертности от оппортунистических инфекций не наблюдалось[6].
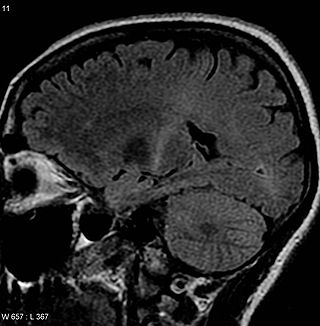
В октябре 2010 года Hoffmann-La Roche анонсировала предварительные результаты 24 недель исследования фазы II при рецидивирующе-ремиттирующем рассеянном склерозе. Окрелизумаб продемонстрировал статистически значимое снижение активности заболевания, измеряемой по количеству бляшек в мозгу на МРТ и частоты рецидивов, в сравнении с плацебо. Обе дозы окрелизумаба (200 мг и 600 мг) хорошо переносились.
В 2017 году Управление по контролю качества лекарственных средств и продуктов питания США (FDA) одобрило препарат окрелизумаб (под торговой маркой «Окревус») в качестве первого и на момент 2018 года единственного препарата, подходящего для лечения двух форм рассеянного склероза — первично-прогрессирующей и рецидивирующей.[7]
В отдельном исследовании III фазы по ППРС (ORATORIO), ОКРЕВУС оказался первым и единственным препаратом, значительно замедлившим прогрессирование инвалидизации и снизившим активность заболевания на снимках МРТ по сравнению с плацебо при медиане наблюдения 3 года. В исследовании ППРС относительное число пациентов с нежелательными явлениями и серьёзными нежелательными явлениями в группах окрелизумаба и плацебо было сопоставимо. Наиболее распространенными нежелательными явлениями были инфузионные реакции, а также инфекции верхних дыхательных путей — в основном легкой и средней степеней тяжести. Результаты этих исследований III фазы были опубликованы 19 января 2017 в издании New England Journal of Medicine (NEJM)[8].
В дополнительных открытых этапах исследований III фазы OPERA I и OPERA II, у пациентов с рецидивирующим рассеянным склерозом, получавших непрерывное лечение окрелизумабом в течение пяти лет, были достигнуты более благоприятные результаты оценки атрофии головного мозга и подтвержденного прогрессирования инвалидизации, по сравнению с теми пациентами, кто перешел на окрелизумаб после первых двух лет лечения интерфероном β-1а. Также у пациентов, заменивших интерферон β-1 на окрелизумаб после контролируемого этапа в исследовании, наблюдалось быстрое подавление активности заболевания, определяемой по среднегодовой частоте обострений и МРТ-показателям[9].
См. также
Другие антагонисты CD20:
- Ритуксимаб, химерное анти-CD20 антитело.
- Офатумумаб, полностью человеческое анти-CD20 антитело.
Примечания
- ↑ K. John Morrow Jr (2008-06-15). "Methods for Maximizing Antibody Yields". Genetic Engineering & Biotechnology News. Mary Ann Liebert, Inc. p. 36. Архивировано 13 февраля 2009. Дата обращения: 6 июля 2008. (Note: information included in this article only found in table present in print version of article.)
- ↑ Kausar, F; Mustafa, K; Sweis, G; Sawaqed, R; Alawneh, K; Salloum, R; Badaracco, M; Niewold, TB; Sweiss, N.J. Ocrelizumab: a step forward in the evolution of B-cell therapy (англ.) // Expert opinion on biological therapy : journal. — 2009. — Vol. 9, no. 7. — P. 889—895. — doi:10.1517/14712590903018837. — PMID 19463076.
- ↑ Clinical trial number NCT00539838 for "A Study to Evaluate Two Doses of Ocrelizumab in Patients With Active Systemic Lupus Erythematosus (BEGIN)" at ClinicalTrials.gov
- ↑ Clinical trial number NCT00676715 for "A Study of the Efficacy and Safety of Ocrelizumab in Patients With Relapsing-Remitting Multiple Sclerosis" at ClinicalTrials.gov
- ↑ Hutas, G. Ocrelizumab, a humanized monoclonal antibody against CD20 for inflammatory disorders and B-cell malignancies (англ.) // Current opinion in investigational drugs (London, England : 2000) : journal. — 2008. — Vol. 9, no. 11. — P. 1206—1215. — PMID 18951300.
- ↑ Katie Reid (2010-03-08). Update 2. Roche suspends arthritis treatment after deaths. Архивная копия от 23 мая 2010 на Wayback Machine Reuters. Retrieved 2010-03-08.
- ↑ OCREVUS- ocrelizumab injection (англ.). DailyMed. U. S. National Library of Medicine.
- ↑ Funded by F. Hoffmann-La Roche Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis Архивная копия от 16 мая 2018 на Wayback Machine ORATORIO ClinicalTrials.gov number, NCT01194570
- ↑ Получены результаты долгосрочных испытаний окрелизумаба Архивная копия от 22 октября 2018 на Wayback Machine Remedium.ru
Ссылки
- Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis Архивная копия от 12 мая 2018 на Wayback Machine New England Journal of Medicine. (2017). 376(3)
- Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis Архивная копия от 20 марта 2018 на Wayback Machine New England Journal of Medicine. (2017). 376(3)
- A Study to Evaluate the Effects of Ocrelizumab on Immune Responses In Participants With Relapsing Forms of Multiple Sclerosis Архивная копия от 20 марта 2018 на Wayback Machine
- «Окревус» на сайте Европейского медицинского агентства (European Medicines Agency) Архивная копия от 20 марта 2018 на Wayback Machine