Оксалаты
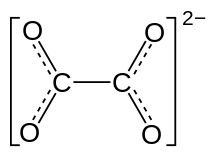
Оксала́ты — соли и эфиры щавелевой кислоты. Соли содержат в своём составе дианион (оксалат) C2O42− или (COO)22−, образующийся при двойном депротонировании щавелевой кислоты.
Другие оксалаты
Существуют также кислые оксалаты — гидрооксалаты, например, гидрооксалат натрия (NaHC2O4). Cуществуют также кислые соли, например, гидрооксалат калия (KHC2O4 • H2C2O4)
Свойства
Свойства солей
Большинство солей оксалатов малорастворимы в воде, например, оксалат кальция, который используется для обнаружения кальция. Хорошо растворимы оксалат калия и аммония.
Оксалаты проявляют восстановительные свойства. Так, его концентрацию в растворе можно определить титрованием перманганатом калия тёплого раствора. Реакция автокаталитическая.
Оксалаты распадаются при нагревании, однако продукты могут быть разными в зависимости от металла и условий.
активные металлы:
неактивные металлы:
Комплексообразование
Анион оксалата может выступать в качестве бидентатного лиганда, образуя пятичленный цикл — MO2C2, как например, в ферриоксалате калия — K3[Fe(C2O4)3]. Благодаря его хорошей растворимости щавелевая кислота используется для удаления ржавчины.
Нахождение в природе
Оксалаты широко распространены в природе, например, в щавеле, кислице. Корни и/или листья ревеня, гречихи и псевдозерновая культура киноа содержат щавелевую кислоту. Накопление щавелевой кислоты происходит из-за неполного окисления углеводов в процессе биосинтеза.
Следующие съедобные растения содержат оксалаты в порядке уменьшения концентрации: карамбола, чёрный перец, петрушка, семена мака, щирица, шпинат, мангольд, сахарная свекла, какао, фасоль, а также большинство орехов и ягод []
Листья чайного куста содержат большое относительное количество оксалатов по отношению к другим растениям. Обычно его экстракты содержат от малых до средних концентраций оксалатов благодаря малой массе используемых листьев. []
Физиологические свойства
Оксалаты токсичны. Сродство оксалата к двухвалентным катионам отражается в способности к образованию нерастворимых осадков. Так в организме оксалат соединяется с катионами, такими как Ca2+, Fe2+ и Mg2+. Вследствие чего накапливаются кристаллы соответствующих оксалатов, которые из-за своей формы раздражают кишечник и почки. Поскольку оксалаты связывают важные элементы, например кальций, то долгое питание пищей, содержащей много оксалатов, может вызвать проблемы со здоровьем.
Здоровый человек может безопасно питаться пищей с оксалатами в умеренных количествах, но для людей с болезнями почек, подагрой, ревматоидным артритом рекомендуется избегать пищи с большим количеством оксалатов. Кристаллы оксалата кальция, более известные как почечный камень, забивают почечные протоки. Считается, что 80 % почечных камней образуется из оксалата кальция.
Аналогично, большие поступления кальция совместно с пищей содержащей оксалаты приводит к выпадению оксалата кальция в пищеварительном тракте, уменьшая поступления оксалатов в организм на 97 %.
Оксалаты являются антинутриентом, связываются с кальцием и мешают организму всасывать этот минерал[1].
Примечания
- ↑ Laurie C. Dolan, Ray A. Matulka, George A. Burdock. Naturally Occurring Food Toxins (англ.) // Toxins. — 2010-09. — Vol. 2, iss. 9. — P. 2289–2332. — ISSN 2072-6651. — doi:10.3390/toxins2092289. Архивировано 20 августа 2022 года.





















