Оксиды азота
Окси́ды азо́та — неорганические бинарные соединения азота с кислородом.
Список оксидов
Известны 10 соединений азота с кислородом. Кроме пяти классических оксидов азота — закиси азота N2O, окиси азота NO, оксида азота(III) N2O3, диоксида азота NO2 и оксида азота(V) N2O5 — известны также димер диоксида азота N2O4 и 4 малостабильных соединения: нитрозилазид NON3, нитрилазид NO2N3, тринитрамид N(NO2)3 и нитратный радикал NO3.
N2O
Оксид азота N2O (оксид диазота, закись азота) — несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза, в высоких концентрациях токсичен. Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания — содержащее её вещество впрыскивается во впускной (всасывающий) коллектор двигателя вместе с горючим, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси;
- увеличивает содержание кислорода в поступающем заряде;
- повышает скорость (интенсивность) сгорания топливной смеси в цилиндрах двигателя.
NO
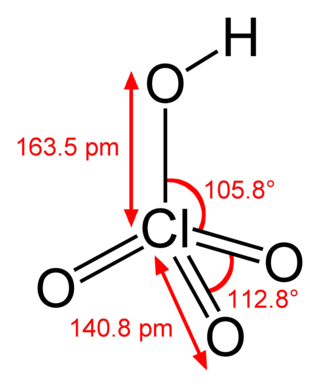
Оксид азота N2O3 (азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NO2
Оксид азота NO2 (диоксид азота) — бурый ядовитый газ тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
и растворами щелочей:
N2O5(V)
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Литература
- Химическая энциклопедия / Редкол.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Леонтьев А. В., Фомичева О. А., Проскурнина М. В., Зефиров Н. С. Современная химия оксида азота(I) // Успехи химии. — Российская академия наук, 2001. — Т. 70, № 2. — С. 107—122.
- Weller, Richard, Could the sun be good for your heart? Архивы TedxGlasgow. Filmed March 2012, posted January 2013
- Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- Stryer, Lubert. Biochemistry, 4th Edition. — W.H. Freeman and Company, 1995. — P. 732. — ISBN 0-7167-2009-4.
- Plant-based Diets | Plant-based Foods | Beetroot Juice | Nitric Oxide VegetablesАрхивы . Berkeley Test.
- Ghosh, S. M.; Kapil, V.; Fuentes-Calvo, I.; Bubb, K. J.; Pearl, V.; Milsom, A. B.; Khambata, R.; Maleki-Toyserkani, S.; Yousuf, M.; Benjamin, N.; Webb, A. J.; Caulfield, M. J.; Hobbs, A. J.; Ahluwalia, A. Enhanced Vasodilator Activity of Nitrite in Hypertension: Critical Role for Erythrocytic Xanthine Oxidoreductase and Translational Potential (англ.) // Hypertension : journal. — 2013. — Vol. 61, no. 5. — P. 1091—1102. —