Оксид вольфрама(IV)
| Оксид вольфрама(IV) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Оксид вольфрама(IV) |
| Традиционные названия | Окись вольфрама, двуокись вольфрама, диоксид вольфрама |
| Хим. формула | WO2 |
| Физические свойства | |
| Состояние | коричневые кристаллы |
| Молярная масса | 215,85 г/моль |
| Плотность | 10,9—11,1; 12,11 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1270; 1530 °C |
| • кипения | 1700; 1730 °C |
| Мол. теплоёмк. | 55,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −588,1 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12036-22-5 |
| PubChem | 82850 |
| Рег. номер EINECS | 234-842-7 |
| SMILES | |
| InChI | |
| ChemSpider | 74762 и 10619276 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д вольфра́ма(IV) (другие названия: диоксид вольфрама, двуокись вольфрама) — неорганическое соединение, оксид металла вольфрама с формулой WO2, коричневые кристаллы, не растворимые в воде.
Получение
- Восстановление оксида вольфрама(VI) водородом:
- Восстановление оксида вольфрама(VI) металлическим вольфрамом:
- Восстановление оксида вольфрама(VI) углеродом:
Физические свойства
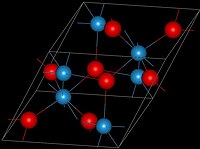
Оксид вольфрама(IV) образует коричневые кристаллы моноклинной сингонии, пространственная группа P 21, параметры ячейки a = 0,5650 нм, b = 0,4892 нм, c = 0,5550 нм, β = 120,42°, Z = 4.
Разлагается при нагревании до 1852°С.
Не растворяется в воде.
Химические свойства
- Окисляется при нагревании на воздухе:
- Реагирует при нагревании с концентрированными кислотами:
- Реагирует при нагревании с концентрированными щелочами:
- Реагирует при нагревании с оксидом азота(IV):
- Реагирует при нагревании с оксидом азота(I):
- Реагирует при нагревании с серой:
- Реагирует при нагревании с тетрахлорметаном:
См. также
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.