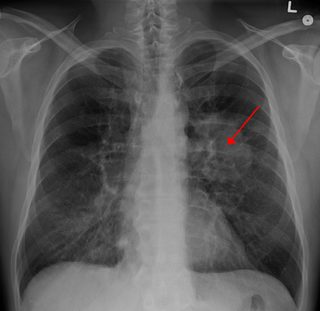
Онкогенез
Онкогене́з (от др.-греч. όγκος — тяжесть, груз, и др.-греч. γένεσις — зарождение, развитие) или канцерогене́з — сложный патофизиологический процесс зарождения и развития опухоли[1].
Общие сведения
Изучение процесса онкогенеза является ключевым моментом как для понимания природы опухолей, так и для поиска новых и эффективных методов лечения онкологических заболеваний. Онкогенез — сложный многоэтапный процесс, глубокая реорганизация нормальных клеток организма. Из всех предложенных к настоящему моменту теорий онкогенеза, мутационная теория заслуживает наибольшего внимания. Согласно этой теории, опухоли являются генетическими заболеваниями, патогенетическим субстратом которых является повреждение генетического материала клетки (точечные мутации, хромосомные аберрации и т. п.). Повреждение специфических участков ДНК приводит к нарушению механизмов контроля за пролиферацией и дифференцировкой клеток и, в конце концов, к возникновению опухоли[2].
Генетические аспекты онкогенеза
Генетический аппарат клеток обладает сложной системой контроля деления, роста и дифференцировки клеток. Изучены две регулирующие системы, оказывающие кардинальное влияние на процесс клеточной пролиферации.
Протоонкогены
Протоонкогены — это группа нормальных генов клетки, оказывающих стимулирующее влияние на процессы клеточного деления, посредством специфических продуктов их экспрессии. Превращение протоонкогена в онкоген (ген, определяющий опухолевые свойства клеток) является одним из механизмов возникновения опухолевых клеток. Это может произойти в результате мутации протоонкогена с изменением структуры специфического продукта экспрессии гена, либо же повышением уровня экспрессии протоонкогена при мутации его регулирующей последовательности (точечная мутация) или при переносе гена в активно транскрибируемую область хромосомы (хромосомные аберрации). На данный момент изучена канцерогенная активность протоонкогенов группы ras (HRAS, KRAS2). При различных онкологических заболеваниях регистрируется значительное повышение активности этих генов (рак поджелудочной железы, рак мочевого пузыря и т. д.).
Гены-супрессоры опухолей
Функции генов-супрессоров противоположны функциям протоонкогенов. Гены-супрессоры оказывают тормозящее влияние на процессы клеточного деления и выхода из дифференцировки. Доказано, что в ряде случаев инактивация генов-супрессоров с исчезновением их антагонистического влияния по отношению к протоонкогенам ведет к развитию некоторых онкологических заболеваний. Так, потеря участка хромосомы, содержащего гены-супрессоры, ведет к развитию таких заболеваний, как ретинобластома, опухоль Вильмса и др.
Таким образом, система протоонкогенов и генов-супрессоров формирует сложный механизм контроля темпов клеточного деления, роста и дифференцировки. Нарушения этого механизма возможны как под влиянием факторов внешней среды, так и в связи с геномной нестабильностью — теория, предложенная Кристофом Лингауром и Бертом Фогельштейном. Питер Дюсберг из Калифорнийского университета в Беркли утверждает, что причиной опухолевой трансформации клетки может быть анеуплоидия (изменение числа хромосом или потеря их участков), являющаяся фактором повышенной нестабильности генома.
По мнению некоторых ученых, ещё одной причиной возникновения опухолей мог бы быть врождённый или приобретённый дефект систем репарации клеточной ДНК. В здоровых клетках процесс репликации (удвоения) ДНК протекает с большой точностью благодаря функционированию специальной системы исправления пострепликационных ошибок. В геноме человека изучено, по крайней мере, 6 генов, участвующих в репарации ДНК. Повреждение этих генов влечёт за собой нарушение функции всей системы репарации, и, следовательно, значительное увеличение уровня пострепликационных ошибок, то есть мутаций (Lawrence A. Loeb).
Онкогенные факторы
На данный момент известно большое количество факторов, способствующих развитию онкогенеза:
Химические факторы
Вещества ароматической природы (полициклические и гетероциклические ароматические углеводороды, ароматические амины, бензол), диоксины, некоторые металлы и их органические и неорганические соединения (кадмий, бериллий, никель, соединения шестивалентного хрома, такие как дихромат калия), соединения мышьяка, некоторые пластмассы обладают выраженным канцерогенным свойством благодаря их способности реагировать с ДНК клеток, нарушая её структуру (мутагенная активность). Канцерогенные вещества в значительных количествах содержатся в продуктах горения каменного угля, автомобильного и авиационного топлива, в табачном дыме, в очень больших количествах образуются при сжигании бытового мусора (из-за чего на мусоросжигательных заводах требуются сложные и дорогие системы очистки дымовых газов). При длительном контакте организма человека с этими веществами могут возникнуть такие заболевания, как рак легкого, рак толстого кишечника и др. Известны также эндогенные химические канцерогены (ароматические производные аминокислоты триптофана), вызывающие гормонально зависящие опухоли половых органов.
Физические факторы
Солнечная радиация (в первую очередь ультрафиолетовое излучение) и ионизирующее излучение также обладает высокой мутагенной активностью. Так, после аварии Чернобыльской АЭС отмечено резкое увеличение заболеваемости раком щитовидной железы у людей, проживающих в зараженной зоне. Длительное механическое или термическое раздражение тканей также является фактором повышенного риска возникновения опухолей слизистых оболочек и кожи (рак слизистой рта, рак кожи, рак пищевода).
Радон-222 является одной из главных и наиболее распространённых причин развития рака лёгких, наряду с табакокурением.
Радий-226 и стронций-90 обладают химическими свойствами, схожими с таковыми у кальция, так как являются щелочноземельными металлами, и склонны к аккумуляции в костях, при этом практически не выводятся из организма. Их воздействие на клетки костной ткани вызывает остеогенную саркому (остеосаркому) - крайне злокачественную и агрессивную опухоль костной ткани, и лейкозы.
Биологические факторы
Канцерогенная активность вируса папилломы человека связывается с развитием рака шейки матки[3], вируса гепатита B в развитии рака печени, ВИЧ — в развитии саркомы Капоши. Попадая в организм человека, вирусы активно взаимодействуют с его ДНК, что в некоторых случаях вызывает трансформацию собственных протоонкогенов человека в онкогены. Геном некоторых вирусов (ретровирусы) содержит высокоактивные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека.
Наследственная предрасположенность
Изучено более 200 наследственных заболеваний, характеризующихся повышенным риском возникновения опухолей различной локализации. Развитие некоторых типов опухолей связывают с врожденным дефектом системы репарации ДНК (пигментная ксеродерма)[4].
Биологические механизмы онкогенеза
Теория четырёхстадийного онкогенеза
Материальным субстратом опухолевой трансформации клеток являются различного типа повреждения генетического аппарата клетки (соматические мутации, хромосомные аберрации, рекомбинации), вызывающие превращение протоонкогенов в онкогены или резко повышающие уровень их экспрессии. Гиперэкспрессия клеточных онкогенов, вызывающая опухолевую трансформацию, может иметь место также и в случае стойкого деметилирования их ДНК при отсутствии каких бы то ни было повреждений самих онкогенов. Следствием данных изменений является возникновение на каком-либо уровне внутриклеточных сигнальных каскадов несанкционированного пролиферативного сигнала, вызывающего бесконтрольное деление клеток. Повреждение генетического материала клетки происходит под воздействием внешних и внутренних канцерогенных факторов, рассмотренных выше. Первичное воздействие канцерогенного фактора на клетку носит название «инициации» и заключается в возникновении потенциально трансформирующего изменения клеточных онкогенов, а также несанкционированном выключении генов-супрессоров или генов, вызывающих апоптоз и активизации генов, препятствующих апоптозу. Внутриклеточные сигнальные каскады устроены таким образом, что нарушение лишь одного из их звеньев вызовет апоптоз клетки, а не её бесконтрольное деление, поэтому для успешного канцерогенеза необходимы изменения многих звеньев, максимально имитирующие влияние цитокинов и устраняющие возможность гибели клетки. Это первая стадия канцерогенеза.
Однако для осуществления опухолевой трансформации клетки — «промоции» — необходимо повторное воздействие на клетку или канцерогенного фактора (того же, что вызвал инициацию, или другого), или фактора, не являющегося канцерогеном, но способного вызвать активизацию изменённых онкогенов — промотора. Как правило, промоторы вызывают пролиферацию клеток посредством активизации пролиферативных сигнальных каскадов, прежде всего протеинкиназы С. Промоция — вторая стадия канцерогенеза. Образование опухолей вследствие воздействия онкогенных ретровирусов, привносящих в клетку активный онкоген, эквивалентно осуществлению первых двух стадий канцерогенеза — в этом случае инициация имела место в других клетках иного организма, где изменённый онкоген был захвачен в геном ретровируса.
Появление несанкционированных сигналов является хотя и необходимым, но не достаточным условием образования опухоли. Опухолевый рост становится возможным лишь после осуществления ещё одной, третьей, стадии канцерогенеза — уклонения трансформированных клеток от дальнейшей дифференцировки, которое обычно вызывается несанкционированной активностью генов некоторых клеточных микроРНК. Последние препятствуют функционированию белков, отвечающих за протекание специализации клеток; известно, что не менее 50 % опухолей ассоциированы с теми или иными повреждениями в участках генома, которые содержат гены микроРНК. Прекращение дифференцировки возможно также из-за отсутствия цитокинов, необходимых для перехода созревающих клеток на следующий этап специализации (в этом случае присутствие цитокина может вызвать нормализацию и продолжение дифференцировки раковых клеток — процесс, обратный канцерогенезу). Созревание трансформированных клеток приостанавливается, и они — в результате непрерывной пролиферации и подавления апоптоза — накапливаются, формируя опухоль — клон клеток, обладающих рядом особенностей, не свойственных нормальным клеткам организма. Так, в частности, для опухолевых клеток характерен высокий уровень анеуплоидии и полиплоидии, что является результатом нестабильности генома. Также наблюдаются различные нарушения митоза. Клетки опухоли с наиболее распространённым набором хромосом образуют стволовую линию.
В ходе развития опухоли, в силу её генетической нестабильности, происходит частое изменение её клеточного состава и смена стволовой линии Такая стратегия роста имеет адаптативный характер, так как выживают только наиболее приспособленные клетки. Мембраны опухолевых клеток не способны реагировать на стимулы микроокружения (межклеточная среда, кровь, лимфа), что приводит к нарушению морфологических характеристик ткани (клеточный и тканевой атипизм). Сформировавшийся опухолевый клон (стволовая линия) синтезирует собственные цитокины и идёт по пути наращивания темпов деления, предотвращения истощения теломер, уклонения от иммунного надзора организма и обеспечения интенсивного кровоснабжения. Это четвёртая, заключительная стадия канцерогенеза — опухолевая прогрессия. Её биологический смысл заключается в окончательном преодолении препятствий на пути опухолевой экспансии. Опухолевая прогрессия носит скачкообразный характер и зависит от появления новой стволовой линии опухолевых клеток. Прорастая в кровеносные и лимфатические сосуды опухолевые клетки разносятся по всему организму и, оседая в капиллярах различных органов, формируют вторичные (метастатические) очаги опухолевого роста.[5].
Иммунологические особенности онкологических процессов
Существует мнение, что в организме человека постоянно образуются потенциальные опухолевые клетки. Однако в силу своей антигенной гетерогенности они быстро распознаются и разрушаются клетками иммунной системы. Таким образом, нормальное функционирование иммунной системы является основным фактором натуральной защиты от опухолей. Этот факт доказан клиническими наблюдениями за больными с ослабленной иммунной системой, у которых опухоли встречаются в десятки раз чаще, чем у людей с нормально работающей иммунной системой. Иммунный механизм сопротивляемости опухолям опосредован большим количеством специфических клеток (В- и Т-лимфоциты, NK-клетки, моноциты, полиморфо-ядерные лейкоциты) и гуморальных механизмов. В процессе опухолевой прогрессии клетки опухоли оказывают выраженное антииммунное действие, что приводит к ускорению темпов роста опухоли и появлению метастазов. Надо сказать, что у лиц с иммуносупрессией если и повышается частота опухолей, то специфических, редких в обычной популяции — саркомы редких видов, лимфомы. Частота классических форм рака не меняется.
Стадии формирования опухоли
Выделяют следующие стадии формирования опухоли[6]
- Гиперплазия ткани
- Доброкачественная опухоль
- Дисплазия
- Рак in situ
- Инвазивный рак
Вторая стадия (формирование доброкачественной опухоли) может отсутствовать.
Рак in situ прорастает базальную мембрану. Опухолевые клетки разрушают и замещают собой предсуществующий эпителий. В дальнейшем раковые клетки врастают в лимфатические и кровеносные сосуды с последующим переносом опухолевых клеток и образованием метастазов.
Влияние опухоли на организм
Доброкачественные опухоли (для них характерен медленный неинвазивный рост и отсутствие метастазов) практически не влияют на общее состояние больного и проявляются лишь симптомами сдавления прилежащих органов (по этой причине смертельно опасны даже доброкачественные опухоли головного мозга). Злокачественные опухоли, напротив ведут к прогрессивному ухудшению состояния больного, состоянию общей истощённости и поражению различных органов метастазами с дальнейшим нарушением их работы[7]. Защитной реакцией организма на рост злокачественного новообразования и его метастазов на поздних стадиях является синдром анорексии-кахексии - потеря мышечной и жировой ткани с изменением обмена веществ и появлением выраженного отвращения к пище (особенно к мясным блюдам и продуктам) и насыщением от очень малых порций пищи, зачастую именно этот синдром является причиной смерти больного, особенно выражен для рака поджелудочной железы и колоректального рака. Характерен практически для всех злокачественных новообразований на поздних стадиях
См. также
- Мутационная теория канцерогенеза
- Цитогенетика злокачественного роста
- Злокачественная опухоль
- Доброкачественная опухоль
Примечания
- ↑ ОНКОГЕНЕ́З : [арх. 28 июня 2020] / О. В. Баженова, Е. В. Даев // Океанариум — Оясио. — М. : Большая российская энциклопедия, 2014. — С. 207. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 24). — ISBN 978-5-85270-361-3.
- ↑ Коган А. Х. Патофизиология опухолей М., 1991
- ↑ Development of Modern Knowledge about Cancer Causes &124; American Cancer Society (англ.). www.cancer.org. Дата обращения: 24 октября 2019. Архивировано 6 октября 2019 года.
- ↑ Худолей В. В. Канцерогены:характеристики, закономерности, механизмы действия СПб., 1999
- ↑ Галицкий В. А. Канцерогенез и механизмы внутриклеточной передачи сигналов // Вопросы онкологии.- 2003.- Т.49, № 3.- С.278-293.
- ↑ Ганцев Ш.К. Онкология: Учебник для студентов медицинских вузов. — М.: ООО «Медицинское информационное агентство», 2006. — 488 с. — 5000 экз. — ISBN 5-89481-418-9.
- ↑ Влияние опухолей на организм. Дата обращения: 18 февраля 2007. Архивировано из оригинала 31 августа 2007 года.
Ссылки
- Материалы по онкологии от Российской Академии Наук. Архивировано 12 февраля 2007 года.