Ква́нтовая хи́мия — направление теоретической химии, рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики. Разделами квантовой химии являются: квантовая теория строения молекул, квантовая теория химических связей и межмолекулярных взаимодействий, квантовая теория химических реакций и реакционной способности и др. Она занимается рассмотрением химических и физических свойств веществ на атомарном уровне. Вследствие того, что сложность изучаемых объектов во многих случаях не позволяет находить явные решения уравнений, описывающих процессы в химических системах, применяют приближенные методы расчета. С квантовой химией неразрывно связана вычислительная химия — дисциплина, использующая математические методы квантовой химии, адаптированные для создания специальных компьютерных программ, используемых для расчета молекулярных свойств, амплитуды вероятности нахождения электронов в атомах, симуляции взаимодействия молекул.

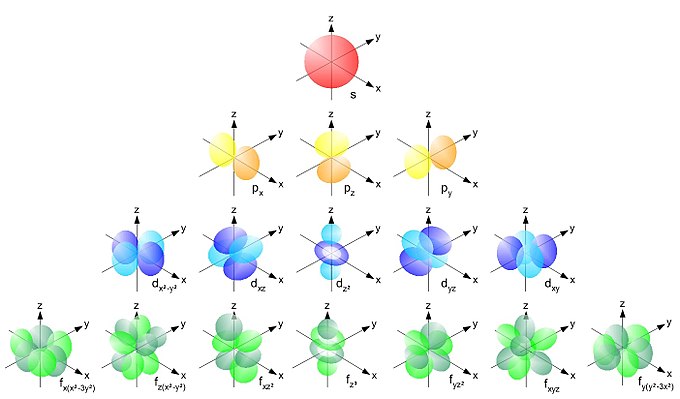
Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома, химического элемента или молекулы.

Правило Клечковского — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Принцип исключения Паули — квантово-механический принцип, который гласит, что два или более идентичных фермиона не могут одновременно находиться в одном и том же квантовом состоянии в квантовой системе. Этот принцип был сформулирован австрийским физиком Вольфгангом Паули в 1925 году для электронов, а затем распространился на все фермионы в его теореме о связи спина со статистикой в 1940 году.
Зо́нная тео́рия твёрдого те́ла — квантовомеханическая теория движения электронов в твёрдом теле.
Химическая связь — взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи — прочность, длина, полярность, устойчивость.

Теория молекулярных орбиталей (МО) даёт представление о распределении электронной плотности и объясняет свойства молекул.

Гибридиза́ция орбита́лей — процесс смешения различных атомных орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим правилам. Угол между гибридными орбиталями при sp3-гибридизации равен 109.5°, при sp2 — 120°, при sp — 180°.
Метод Хартри — Фока — в квантовой механике приближённый метод решения уравнения Шрёдингера путём сведения многочастичной задачи к одночастичной в предположении, что каждая частица двигается в некотором усреднённом самосогласованном поле, создаваемом всеми остальными частицами системы. Решение уравнения Шрёдингера позволяет получить целый ряд сведений о свойствах системы, в том числе и её электронную структуру.
Базисный набор — набор функций, который используется для построения молекулярных орбиталей, которые представляются как линейная комбинация функций этого набора с определенными весами или коэффициентами. Обычно этими функциями являются атомные орбитали, центрированные на атомах, хотя иногда функции центрируют на связях, на половинах p-орбитали и т. п.
Электро́нное о́блако — наглядная модель, иллюстрирующая распределение плотности вероятности нахождения электрона по координатам, обычно в атоме или молекуле. Конфигурация облака может быть разной в зависимости от энергии и квантового состояния электрона.

Сэр Джон Энтони Попл — английский химик-теоретик, один из основателей современной вычислительной химии. Создатель одной из наиболее широко используемых квантово-химических программ Gaussian. Лауреат Нобелевской премии по химии (1998) и других престижных наград.

Джон Кларк Слэ́тер — американский физик и химик-теоретик.
Орбитали слэтеровского типа — это один из видов базисных функций, используемых в вычислительной химии. Орбитали слэтеровского типа были введены по аналогии с атомными орбиталями в рамках метода МО ЛКАО. Носят название в честь Джона К. Слэтера, который и предложил их использование в 1930 году.
Одноэлектронная химическая связь — это простейшая химическая связь, обуславливающая существование молекулярных соединений посредством кулоновского удерживания двух атомных ядер одним электроном. Главные отличительные черты одноэлектронной химической связи — это понижение полной энергии молекулярной системы по сравнению с энергией изолированных атомов и атомных фрагментов, из которых она образована, а также существенное перераспределение электронной плотности в области одноэлектронной химической связи по сравнению с простым наложением электронной плотности атома и атомного фрагмента, сближенных на расстоянии связи.

Теория валентных связей — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Одноэлектронное приближение — приближённый метод нахождения волновых функций и энергетических состояний квантовой системы со многими электронами.

Молекулярные орбитали — математическая функция, описывающая волновое поведение электронов в молекуле.
МО ЛКАО или МО ЛКБФ — простейший метод определения волновых функций молекулярных орбиталей. Рассматривает волновые функции молекулярных орбиталей как линейные комбинации волновых функций атомных орбиталей. Для точного определения волновой функции молекулярной орбитали необходимо решить сложную даже для простейших молекул задачу о движении одного электрона в самосогласованном поле, создаваемым атомными ядрами и остальными электронами всех атомов, входящих в молекулу. Поэтому в методе МО ЛКАО используются упрощающие исходную задачу предположения.