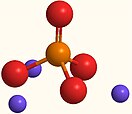
Ортофосфат натрия
| Ортофосфат натрия | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование | натрия ортофосфат | ||
| Традиционные названия | Тринатрийфосфат; фосфат натрия нейтральный | ||
| Хим. формула | Na3PO4 | ||
| Рац. формула | Na3PO4 | ||
| Физические свойства | |||
| Состояние | твёрдое кристаллическое вещество | ||
| Примеси | вода, входит в состав кристаллогидратов ортофосфатов натрия | ||
| Молярная масса | 163,94067 г/моль | ||
| Плотность | безводный - 2,536; кристаллогидрат - 1,62 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | безводный - 1340; кристаллогидрат - 73,3÷76,7 °C | ||
| Энтальпия | |||
| • образования | безводный -1922,8; кристаллогидрат -4471,6 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | в пересчете на безводный 12,1(0°С); 94,6(100°С) | ||
| Классификация | |||
| Рег. номер CAS | 7601-54-9 | ||
| PubChem | 24243 и 517071 | ||
| Рег. номер EINECS | 231-509-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E339(iii) | ||
| RTECS | TC9575000 | ||
| ChEBI | 37583 | ||
| ChemSpider | 22665 | ||
| Безопасность | |||
| Предельная концентрация | 10 мг/дм³ (по фосфат-ионам) | ||
| Токсичность | 5660 mg/kg—1 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ортофосфа́т на́трия (фосфа́т на́трия, в просторечии — трина́трийфосфа́т, фосфа́т на́трия нейтра́льный; фосфорнокислый натрий) — неорганическое соединение, натриевая соль ортофосфорной кислоты с химической формулой Na3PO4. Образует кристаллогидрат состава Na3PO4·12H2O. Входит в Кодекс Алиментариус как пищевая добавка Е339(iii), также используется как водоумягчающее средство.
Описание
Тринатрийфосфат имеет вид белого порошка. Плавится без разложения при температуре 1340 °C, термически устойчивый. Хорошо растворим в воде — 12,1 г / 100 мл. С водой образует кристаллогидрат с общей формулой Na3PO4·12H2O[1].
Получение
1. Взаимодействие H3PO4 с Na2CO3:
2. Взаимодействие H3PO4 с NaOH:
3. Сплавление с щелочью, оксидом, карбонатом, пероксидом и др. солями:
Применение
Применяется для уменьшения жесткости воды. При взаимодействии ортофосфата натрия с соединениями кальция и магния происходит реакция ионного обмена, при этом образуется растворимые соли натрия и нерастворимые фосфаты кальция и магния, которые выпадают в осадок[2].
Использование фосфата натрия в стиральных порошках запрещено или ограничено во многих странах для уменьшения эвтрофикации водоемов.
Зарегистрирован в качестве пищевой добавки E339 (представляет собой смесь различных фосфатов натрия, в том числе и ортофосфата Е339iii). Применяется как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока.
Применяется для обесцвечивания стекла при его плавке.
Безопасность
Ортофосфат натрия в обычных условиях неядовит. ЛД50 на мышах около 5660 мг/кг.
ПДК — 10 мг/дм³ (обязателен контроль полифосфатов). Класс опасности IV по гигиеническим нормативам[3].
Примечания
- ↑ Комиссарова, 1992.
- ↑ При pH обрабатываемой воды >10,5 карбонат кальция переходит в основной ... - Справочник химика 21. Дата обращения: 15 июля 2019. Архивировано 15 июля 2019 года.
- ↑ name=https://studwork.org_Фосфат натрия Na3PO4
Литература
- Комиссарова Л. Н., Мельников П. П. Натрия фосфаты // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 187—188. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
Ссылки
- Аликберова Л. Ю. Натрия фосфаты. Большая Российская Энциклопедия. Министерство культуры Российской Федерации. Дата обращения: 17 августа 2019.
- ГОСТ 31725-2012. Добавки пищевые. Натрия фосфаты Е339. Общие технические условия. ФГУП Стандартинформ. Дата обращения: 17 августа 2019.
- СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок» (с изменениями на 23 декабря 2010 года). Министерство здравоохранения Российской Федерации. Дата обращения: 17 августа 2019.