Палладий
| Палладий | ||||
|---|---|---|---|---|
| ← Родий | Серебро → | ||||
| ||||
| Внешний вид простого вещества | ||||
 Образец палладия | ||||
| Свойства атома | ||||
| Название, символ, номер | Палладий / Palladium (Pd), 46 | |||
| Группа, период, блок | 10 (устар. 8), 5, d-элемент | |||
| Атомная масса (молярная масса) | 106,42(1)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Kr] 4d10 | |||
| Радиус атома | 137 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 128 пм | |||
| Радиус иона | (+4e) 65 (+2e) 80 пм | |||
| Электроотрицательность | 2,20 (шкала Полинга) | |||
| Электродный потенциал | +0,987 | |||
| Степени окисления | 0, +1, +2, +3, +4 | |||
| Энергия ионизации (первый электрон) | 803,5(8,33) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 12,02 г/см³ | |||
| Температура плавления | 1827,15 К (1554 °C) | |||
| Температура кипения | 2940 К (2666,85 °С) | |||
| Мол. теплота плавления | 17,24 кДж/моль | |||
| Мол. теплота испарения | 372,4 кДж/моль | |||
| Молярная теплоёмкость | 25,8[2] Дж/(K·моль) | |||
| Молярный объём | 8,9 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | Кубическая гранецентрированая | |||
| Параметры решётки | 3,890 Å | |||
| Температура Дебая | 274 K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 71,8 Вт/(м·К) | |||
| Номер CAS | 7440-05-3 | |||
| 46 | Палладий |
| 4d10 | |
Палла́дий (химический символ — Pd, от лат. Palladium) — химический элемент 10-й группы (по устаревшей классификации — побочной подгруппы восьмой группы, VIIIB), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 46.
Простое вещество палладий (при нормальных условиях) — это переходный благородный металл платиновой группы (лёгкие платиноиды) серебристо-белого цвета.
История

В 1803 году известный лондонский торговец минералами Форстер получил анонимное письмо с просьбой попытаться продать небольшое количество нового химического элемента — «палладия», слиток которого прилагался к письму[3]. Таинственный металл был выставлен на продажу и привлёк всеобщее внимание[3]. Среди английских химиков разгорелись споры, является ли этот металл действительно новым химическим элементом или же это просто сплав уже ранее известных металлов. Химик Ричард Ченевикс, желая разоблачить «мошенническую подделку», купил слиток «палладия»[3]. Вскоре Ченевикс выступил с докладом перед членами Лондонского Королевского общества, где объявил, что данный металл — всего лишь сплав платины с ртутью. Однако секретарь Королевского общества химик Уильям Хайд Волластон публично усомнился в выводах Ченевикса. Другим химикам не удалось выделить в этом «сплаве» ни платины, ни ртути. Споры вновь обострились и какое-то время активно продолжались. Когда же они стали стихать, в научном журнале Nicholson’s Journal появилось анонимное объявление, что любому, кто в течение года сможет изготовить искусственный палладий, будет выплачена награда в 20 фунтов стерлингов[3]. Интерес к металлу вновь подскочил, но никому так и не удалось его изготовить[3].
В 1804 году Уильям Волластон доложил Королевскому обществу, что в платиновой руде из Южной Америки он обнаружил новые ранее неизвестные металлы — палладий и родий[3]. Стремясь очистить выделенную из руды «сырую» платину от примесей золота и ртути, он растворял её в царской водке, а затем осаждал её из раствора нашатырём[3]. Оставшийся раствор имел розовый оттенок, что было невозможно объяснить присутствием золота и ртути[3]. Тогда в этот раствор был добавлен цинк, что привело к выпадению чёрного осадка[3]. Волластон обнаружил, что если попытаться растворить этот высушенный осадок царской водкой, то часть его растворяется, а часть — нет[3]. После разбавления раствора водой Волластон добавил в него цианид калия, что привело к обильному выпадению осадка уже оранжевого цвета, который при нагревании сначала приобрёл серый цвет, а затем сплавился в капельку металла — палладия, который по удельному весу был легче ртути. Из оставшейся нерастворённой части чёрного осадка им был выделен другой металл — родий[3].
Лишь в феврале 1805 года в Nicholson’s Journal было опубликовано открытое письмо Волластона, в котором он признался, что скандальная шумиха вокруг палладия — дело его рук[3]. Именно он пустил в продажу новый металл, и он же дал анонимное объявление с обещанием премии за его искусственное изготовление, уже располагая доказательством, что палладий — это новый металл[3].
Происхождение названия
Назван по имени астероида Паллада, открытого немецким астрономом Ольберсом в 1802 году, то есть незадолго до открытия палладия. В свою очередь, астероид назван в честь Афины Паллады из древнегреческой мифологии. Палладий, или Палладиум, — упавшее с неба легендарное деревянное изображение Афины Паллады; согласно прорицанию Гелена (сына Приама), Троя останется несокрушимой, пока в её стенах хранится этот талисман. По легенде, лишь после того, как любимцы богини — Одиссей и Диомед — во время ночной вылазки выкрали Палладий, эта твердыня пала.
Нахождение в природе
Один из наиболее редких элементов в земной коре; его кларковое число составляет 1·10−6 %. Встречается в самородном виде (аллопалладий), в виде интерметаллических минералов (палладистая платина, станнопалладинит Pd3Sn2 и др.) и других соединений (палладит PdO, брэггит (Pd, Pt, Ni)S и др.). Известно около 30 минералов палладия. Сопровождает другие платиновые металлы, его содержание в смеси платиноидов в различных месторождениях колеблется от 25 до 60 %[2]. По Гольшмидтовской геохимической классификации элементов, как и все платиноиды, относится к сидерофилам, то есть обладает сродством к железу и концентрируется в ядре Земли[4]. В настоящее время крупнейшее (не разрабатываемое) месторождение палладия в России находится в Мурманской области (Федорово-Панский интрузивный массив).
Получение
Палладий получают главным образом при переработке сульфидных руд никеля, серебра и меди. Некоторую часть мирового производства (около 10 %) получают извлечением из вторичного сырья[2].
Из раствора смеси благородных металлов в царской водке после осаждения золота и платины осаждают дихлородиамминпалладий Pd(NH3)2Cl2, очищают его перекристаллизацией из аммиачного раствора HCl, разлагают до порошкообразного палладия прокаливанием в восстановительной атмосфере, порошок палладия переплавляют[2].
Восстанавливая растворы солей палладия, получают палладиевую чернь — мелкокристаллический порошок палладия[2].
Компактный металлический палладий получают также электроосаждением из нитритных и фосфатных кислых электролитов, например, используя Na2[Pd(NO2)4][2].
Показатели производства
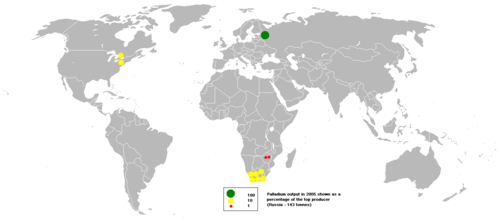
Крупнейшее месторождение палладия находится в России (Норильск, Талнах). Также известны месторождения в Трансваале (ЮАР), Канаде, Аляске, Австралии, Колумбии[5].
Поставки палладия в мире в 2007 году составили 267 тонн (в том числе Россия — 141 тонна, ЮАР — 86 тонн, США и Канада — 31 тонна, прочие страны — 9 тонн). Потребление палладия в 2007 году составило в автомобильной промышленности 107 тонн, в производстве электроники — 40 тонн, в химической промышленности — 12 тонн[6].
По оценке лондонской исследовательской компании GFMS, в 2009 году РФ продала приблизительно 1,1 млн унций палладия, в 2010—800 тыс. унций, в 2011 году объём экспорта будет аналогичным[7].
В декабре 2019 биржевые цены на палладий впервые превысили уровень 1900 долл. за тройскую унцию (при этом был также превышен максимальный уровень цен на золото, достигнутый в 2011 г.)[8]; всего за четыре года биржевые цены на этот металл взлетели в четыре раза — с 510 до 2064 долларов за тройскую унцию (для сравнения: золото за тот же период подорожало только в полтора раза — с 1060 до 1573 долл.), этому способствовало массовое применение палладиевых катализаторов[9][10]
27 февраля 2020 мировые цены на палладий достигли максимума 2795$/унция[11] (после этого последовал резкий спад, но с дальнейшим ростом)[12].
Физические свойства
Полная электронная конфигурация атома палладия: 1s22s22p63s23p63d104s24p64d10.
Палладий — переходный металл. При нормальных условиях образует кристаллы серебристо-белого цвета кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,38902 нм, Z = 4, структурный тип меди.
Палладий пластичен, микродобавки никеля, кобальта, родия или рутения улучшают механические свойства палладия и повышают его твёрдость.
В воде нерастворим. Плотность — 12 020 кг /м³ (при 20 °C); в особых условиях образует коллоидный палладий и палладиевую чернь. Температура плавления — 1554 °C (в других источниках 1552 °C); температура кипения около 2940 °C. Теплота плавления — 16,7 кДж/моль, теплота испарения 353 кДж/моль. Удельная теплоёмкость при 20 °C — 25,8 Дж/(моль·К); удельное электрическое сопротивление при 25 °C — 9,96 мкОм/см; теплопроводность — 75,3 Вт/(м·К). Твёрдость по Виккерсу 37…39[2]. Твёрдость по Бринеллю 52 кгс/мм2.
Температурный коэффициент линейного расширения 1,17·10−5 К−1 (в диапазоне 0…100 °С)[2].
Коэффициент поверхностного натяжения жидкого палладия при температуре плавления равен 0,015 Н/см[2].
Палладий является парамагнетиком; его магнитная восприимчивость равна +5,231·10−6 (при 20 °C)[2].
Активно поглощает водород, образуя твёрдые растворы (до 900 объёмов H2 на один объём Pd), при этом увеличивается постоянная решётки. Водород удаляется из палладия при нагревании до 100 °C в вакууме[2].
Изотопы
Природный палладий состоит из шести стабильных изотопов: 102Pd (1,00 %), 104Pd (11,14 %), 105Pd (22,33 %), 106Pd (27,33 %), 108Pd (26,46 %) и 110Pd (11,72 %).
Наиболее долгоживущий искусственный радиоактивный изотоп 107Pd (Т1/2 7·106 лет). Некоторые изотопы палладия активно образуются в качестве осколков деления урана и плутония; так, в облучённом топливе современных ядерных реакторов при степени выгорания ядерного топлива 3 % содержится 0,15 % палладия[2].
Химические свойства
Палладий является наиболее химически активным из платиновых металлов. Не реагирует с водой, разбавленными кислотами, щелочами, раствором аммиака. Реагирует с горячими концентрированными серной и азотной кислотами, и в отличие от других платиновых металлов растворяется в концентрированной хлорной кислоте, восстанавливая её до хлора:
(все остальные платиновые металлы восстанавливают хлор до степени окисления +5).
Может быть переведён в раствор анодным растворением в соляной и азотной кислоте[2]:
При комнатной температуре реагирует с царской водкой, с влажными хлором и бромом. При нагревании реагирует со фтором, серой, селеном, теллуром, мышьяком и кремнием. Окисляется при сплавлении с гидросульфатом калия KHSO4, взаимодействует также с расплавом пероксида натрия[2].
При нагревании на воздухе устойчив до ~300 °C и выше 850 °C; в диапазоне 300…850 °C тускнеет из-за образования на поверхности плёнки оксида палладия(II) PdO, который при более высокой температуре разлагается[2].
Применение
Катализаторы
Палладий часто применяется как катализатор, в основном в процессе гидрогенизации жиров, крекинге нефти, органическом синтезе (см. катализатор Линдлара, Palladium-catalyzed coupling reactions[англ.]).
Хлорид палладия(II) PdCl2 используется как катализатор и для обнаружения микроколичеств угарного газа в воздухе или газовых смесях.
Водородные технологии
Так как водород очень хорошо диффундирует через палладий, палладиевые мембраны применяют для получения сверхчистого водорода[13]. Для экономии дорогостоящего палладия при производстве мембран для очистки водорода и разделения изотопов водорода разработаны сплавы его с другими металлами, наиболее эффективен и экономичен сплав палладия с иттрием[14].
Также палладий способен исключительно эффективно обратимо аккумулировать водород. См. Palladium hydride[англ.].
Электроника
Хлорид палладия(II) применяется в гальванотехнике, как активирующее вещество при гальванической металлизации диэлектриков — в частности, осаждении меди на поверхность слоистых пластиков при производстве печатных плат.
Применение палладия в электрических контактах обусловлено высокой износоустойчивостью и коррозионной стойкостью. Палладий и сплавы палладия используется для покрытия контактов, устойчивых к действию сульфидов. Палладий используется для производства реохордов прецизионных сопротивлений высокой точности, в том числе в виде сплава с вольфрамом (например, ПдВ-20М).
Палладий входит также в состав керамических конденсаторов (тип КМ), с высокими показателями температурной стабильности ёмкости в высокочастотной аппаратуре радиовещания, радиосвязи, телевидения[15].
В ювелирном и монетном деле

- В сплавах, используемых в ювелирном деле (например, для получения сплава золото-палладий — так называемое «белое золото»). Палладий даже в небольшой концентрации в сплаве (около 1 %) изменяет цвет сплава на основе золота из жёлтого в серебристо-белый. Основные сплавы палладия с серебром, используемые в ювелирном деле, имеют пробы 500 и 850 по серебру (так как наиболее технологичны при механической обработке и декоративны). Процентное содержание золота в сплаве «белое золото» равно 37,5 %. В ювелирном деле применяются сплавы с содержанием палладия до 95 %. Ювелирные изделия с высоким содержанием палладия обладают рядом исключительных свойств: повышенная твёрдость, отсутствие родиевого покрытия.
- Из палладия иногда чеканятся памятные монеты ограниченным тиражом[16].
В медицине
- Из палладия и его сплавов изготавливают медицинские инструменты, детали кардиостимуляторов, зубные протезы;
- В некоторых странах незначительное количество палладия используется для получения цитостатических препаратов — в виде комплексных соединений, аналогично цис-платине.
- Бета-активный палладий-103 используется для брахитерапии в лечении онкозаболеваний.
Другие области применения палладия
- Для изготовления специальной химической посуды, стойких к коррозии деталей высокоточных измерительных приборов, прецизионных механических инструментов.
- Определённое количество палладия расходуется для изготовления химической аппаратуры для производства плавиковой кислоты (сосуды, перегонные кубы, детали насосов, реторты).
- Палладий является драгоценным металлом и торгуется на биржевых и внебиржевых рынках. В некоторых странах, в том числе в России, законодательство разрешает физическим и юридическим лицам открывать в банках обезличенные металлические счета в палладии. В Российской Федерации за незаконное приобретение, хранение, перевозку, пересылку и сбыт палладия (а равно и других драгоценных металлов: золота, серебра, платины, иридия, родия, рутения и осмия[17]) в крупном размере (то есть стоимостью более 2,5 млн рублей[18]), за исключением ювелирных и бытовых изделий и лома таких изделий, предусмотрена уголовная ответственность в виде лишения свободы на срок до 5 лет[19].
Прогнозы потребления и производства
По последним оценкам компании «Норникель», мировой дефицит палладия в 2023 году составит 0,2 млн унций[20]. В то же время объем промышленного потребления палладия увеличится до 9,8 млн унций (рост на 4 % за год), а объем мирового производства — до 6,4 млн унций (рост на 1 % за год)[21].
Биологическая роль
Биологическая роль палладия в организме не установлена. Сам по себе металлический палладий нетоксичен, однако некоторые его соединения, например, хлорид палладия(II)) очень ядовиты.
См. также
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Палладий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 440—441. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Популярная библиотека химических элементов. Книга первая «Водород — Палладий». Изд. 3-е. — М.: Наука, 1983.
- ↑ Войткевич В. Г. Происхождение и химическая эволюция Земли / под ред. Л. И. Приходько. — М.: Наука, 1973. — 168 с.
- ↑ Норильский металл — А что мы знаем про палладий? Архивная копия от 18 сентября 2010 на Wayback Machine[]
- ↑ Бюллетень иностранной коммерческой информации, № 95, 23.08.2008, с.12.
- ↑ Thomson Reuters GFMS | Analytics and content for metals professionals Архивная копия от 24 июля 2011 на Wayback Machine | Thomson Reuters Eikon
- ↑ Палладий превысил исторический максимум золота Архивная копия от 14 декабря 2019 на Wayback Machine // «Вести. Экономика», 12 декабря 2019
- ↑ Экономисты нашли главного виновника в спаде мирового ВВП Архивная копия от 11 января 2020 на Wayback Machine // РИА Новости, 11.01.2020
- ↑ Цена палладия впервые в истории достигла $2 тыс. за унцию. Пробивной металл: палладий сыграет на руку России Архивная копия от 27 марта 2020 на Wayback Machine // Газета.Ru, 18.12.2019
- ↑ Металлический лидер: как рекордный рост цен на палладий может повлиять на российскую промышленность Архивная копия от 14 марта 2020 на Wayback Machine // RT, 28 февраля 2020
- ↑ График цены палладия за доллары США на спотовом рынке Архивная копия от 1 декабря 2020 на Wayback Machine на profinance.ru
- ↑ Леонова Т. Н., Палладий, 1964.
- ↑ Бурханов Г.С.,Горина Н.Б.,Кольчугина Н.Б.,Рошаи Н.Р. Сплавы палладия для водородной энергетики // Российский химический журнал. — 2006. — Т. L, № 4. — С. 36—40. — ISSN 0373-0247 версии 0373-0247. Архивировано 2 апреля 2024 года.
- ↑ «Методика проведения работ по комплексной утилизации вторичных драгоценных металлов из отработанных средств вычислительной техники» (УТВ. ГОСТЕЛЕКОМОМ РФ 19.10.1999)
- ↑ [1] // Сайт Сбербанка Архивная копия от 31 декабря 2014 на Wayback Machine.
- ↑ Согласно статье 1 Федерального закона от 26.03.1998 № 41-ФЗ «О драгоценных металлах и драгоценных камнях» Архивная копия от 26 сентября 2018 на Wayback Machine.
- ↑ Согласно статье 170.2 УК РФ Архивная копия от 30 сентября 2018 на Wayback Machine.
- ↑ Согласно статье 191 УК РФ. Дата обращения: 28 января 2019. Архивировано из оригинала 27 сентября 2018 года.
- ↑ "Норникель" увеличил оценку профицита никеля в 2023 году. Интерфакс (31 мая 2023). Дата обращения: 26 июня 2023. Архивировано 1 июня 2023 года.
- ↑ "Норникель" ожидает роста первичного потребления никеля в мире в 2023 году на 11%. TACC. Дата обращения: 26 июня 2023. Архивировано 8 апреля 2023 года.
Литература
- Леонова Т. Н. Палладий // Краткая химическая энциклопедия. — М.: Советская энциклопедия, 1964. — Т. 3. — С. 423—425 (стб. 845—849).
- Палладий: химия, технология и применение // Российский химический журнал. — 2006. — Т. L, № 4. Тематический выпуск журнала охватывает многочисленные проблемы производства и применения палладия
- Венецкий С.И. Шутка английского ученого (Палладий) // О редких и рассеянных (Рассказы о металлах). — Москва: Металлургия, 1980. — 184 с. — 200 000 экз.
Ссылки
- Mark Winter. Palladium: the essentials (англ.). WebElements. Дата обращения: 4 апреля 2019. Архивировано 4 апреля 2019 года..
- Популярная библиотека химических элементов. Палладий. Электронная библиотека «Наука и техника» (10 июля 2002). Дата обращения: 4 апреля 2019. Архивировано 4 апреля 2019 года..



![{\displaystyle {\ce {Pd + 2 HCl + Cl2 -> H2[PdCl4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa9d1dcb343ac9db153a68aa451721e587538ef5)
![{\displaystyle {\ce {Pd + 2 HCl + 2 Cl2 -> H2[PdCl6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c0b1020d568d301142caaff7249aa90bb89af7cb)

















