Пентакарбонилжелезо
| Пентакарбонилжелезо | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | Пентакарбонилжелезо |
| Традиционные названия | Пентакарбонил железа |
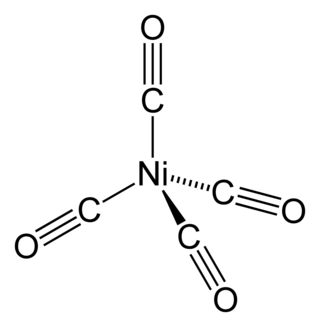
| Хим. формула | [Fe(CO)5] |
| Физические свойства | |
| Состояние | светло-жёлтая жидкость |
| Молярная масса | 195,90 г/моль |
| Плотность | 1,457; 1,4664 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -21; -20 °C |
| • кипения | 102,5; 103; 104,9 °C |
| • вспышки | 5 ± 1 ℉[1] |
| Давление пара | 40 ± 1 мм рт.ст.[1], 1 ± 1 кПа[2], 10 ± 1 кПа[2] и 100 ± 1 кПа[2] |
| Оптические свойства | |
| Показатель преломления | 1,453 ± 0,001[3] и 1,523 ± 0,001[4] |
| Классификация | |
| Рег. номер CAS | 13463-40-6 |
| PubChem | 26040 |
| Рег. номер EINECS | 236-670-8 |
| SMILES | |
| InChI | |
| RTECS | NO4900000 |
| ChEBI | CHEBI:30251 |
| Номер ООН | 1994 |
| ChemSpider | 24254 |
| Безопасность | |
| Предельная концентрация | 0,8 мг/кг |
| ЛД50 | 25 мг/кг |
| Токсичность | Высокотоксичен, СДЯВ |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пентакарбонилжелезо — неорганическое соединение, карбонильный комплекс железа состава [Fe(CO)5]. Светло-жёлтая жидкость, не смешивается с водой.
Получение
- Действие монооксида углерода под давлением на порошок железа:
- Действие монооксида углерода под давлением на иодид железа(II) и медь:
- Разложение при нагревании нонакарбонилдижелеза:
Физические свойства

Пентакарбонилжелезо образует светло-жёлтую диамагнитную жидкость, не смешивается с холодной водой, растворяется в этаноле, диэтиловом эфире, ацетоне, бензоле, уксусной кислоте.
Химические свойства
- Разлагается при нагревании:
- Реагирует с горячей водой:
- Реагирует с кислотами (в диэтиловом эфире):
- Окисляется кислородом:
- Реагирует с иодистоводородной кислотой:
- При облучении ультрафиолетовым светом раствора в уксусной кислоте образуются высшие карбонилы:
- Под действием катализатора алкоголята натрия на раствор в этаноле образуются высшие карбонилы:
- Реагирует с основаниями в метаноле:
- Реагирует с монооксидом азота под давлением:
Применение
- Для получения порошка железа.
- В качестве катализатора.
- В качестве восстановителя в органическом синтезе.[5]
Физиологические свойства
- Пентакарбонил железа [Fe(CO)5] высокотоксичен, как и многие другие карбонилы металлов. Сильнейший неорганический яд.
- ПДК = 0,8 мг/м³.
- ЛД50 = 25 мг/кг.
- Очень опасен для окружающей среды.
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0345.html
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—100. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 3—326. — ISBN 978-1-4822-0868-9
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 4—137. — ISBN 978-1-4822-0868-9
- ↑ Oleg I. Afanasyev, Dmitry L. Usanov, Denis Chusov. Hydrogen-free reductive amination using iron pentacarbonyl as a reducing agent (англ.) // Organic & Biomolecular Chemistry. — 2017. — Vol. 15, iss. 48. — P. 10164–10166. — ISSN 1477-0539 1477-0520, 1477-0539. — doi:10.1039/c7ob02795h. Архивировано 25 ноября 2018 года.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 400 с.












![{\displaystyle {\mathsf {Fe(CO)_{5}+2NaOH\xrightarrow {} \ Na[HFe(CO)_{4}]+NaHCO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a5141b28b63480f6b0e0348ddeed9c42a0270fe0)
![{\displaystyle {\mathsf {Fe(CO)_{5}+Ba(OH)_{2}{\xrightarrow {-15^{o}C}}\ [Fe(CO)_{4}H_{2}]+BaCO_{3}\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/801ad9419ffac154c4429f3be78179bacfd16151)
![{\displaystyle {\mathsf {Fe(CO)_{5}+2Na{\xrightarrow {-40^{o}C}}\ Na_{2}[Fe(CO)_{4}]\downarrow +CO\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d1dd77205525afb19cdc839c61218b085c4e52d)
![{\displaystyle {\mathsf {Fe(CO)_{5}+4NO{\xrightarrow {45^{o}C}}\ [Fe(NO)_{4}]+5CO\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14d9cce5b08541a015b1d0c72165b6faa39a7889)