
Ферме́нты, или энзи́мы , — обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.
Детона́ция — режим горения, при котором по веществу распространяется ударная волна, инициирующая химические реакции горения, в свою очередь, поддерживающие движение ударной волны за счёт выделяющегося в экзотермических реакциях тепла. Комплекс, состоящий из ударной волны и зоны экзотермических химических реакций за ней, распространяется по веществу со сверхзвуковой скоростью и называется детонационной волной. Фронт детонационной волны — это поверхность гидродинамического нормального разрыва.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в другие вещества (продукты), при котором ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.

Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
В конце 50-х — начале 60-х годов XX века Р. Маркус предложил теорию, рассматривающую перенос электрона в полярном растворителе в рамках квазиклассического приближения. Затем теория Маркуса, известная также как теория переходного состояния, была распространена на электрохимические процессы.
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.

Эне́ргия актива́ции в химии — эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры. Выражается в джоулях на моль. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии активации: 
Криохимия — раздел химии, который изучает превращения в жидкой и твёрдой фазах при низких и сверхнизких температурах. По изучаемым явлениям имеет пересечения с физикой конденсированных сред и астрохимией.
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешённых направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Тепловой эффект химической реакции — изменение внутренней энергии  или энтальпии
или энтальпии  системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом является работа против внешнего давления,
- как исходные вещества, так и продукты реакции имеют одинаковую температуру.
Тео́рия реакцио́нной спосо́бности хими́ческих соедине́ний (ТРСХС) — научная дисциплина, занимающаяся изучением механизма химических реакций и механики элементарного акта химического превращения. ТРСХС — относительно молодая отрасль химической науки, активно развивающаяся в последние десятилетия, что связано с прогрессом в областях вычислительной и квантовой химии, а также физико-химических методов анализа.

Реакция Ди́льса — А́льдера — реакция [4+2]-циклоприсоединения диенофилов и сопряжённых диенов с образованием шестичленного цикла.
Реакции нуклеофильного замещения — реакции замещения, в которых атаку осуществляет нуклеофил — реагент, несущий неподеленную электронную пару. Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг.

Альдольная конденсация — химическая реакция между двумя молекулами альдегида или кетона в присутствии кислоты или основания с образованием альдоля, а в некоторых случаях — продукта дегидратации альдоля.
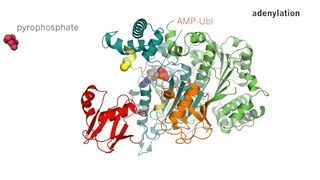
Ферментативный катализ — это увеличение скорости процесса с помощью биологической молекулы, «фермента». Большинство ферментов представляют собой белки, и большинство таких процессов представляют собой химические реакции. Внутри фермента катализ обычно происходит в локализованном центре, называемом активным центром.
Постулат Хэммонда — гипотеза в области физической органической химии, предложенная американским химиком Джорджем Хэммондом. Эта гипотеза гласит, что если переходное состояние ведёт к неустойчивому интермедиату, то оно имеет приблизительно такую же энергию, как этот интермедиат (продукт). Переход между этими двумя состояниями осуществляется за счёт лишь малого изменения структуры молекулы.

Джордж Симс Хэммонд — американский химик-теоретик, внёс большой вклад в развитие изучения фотохимии органических соединений, автор «Постулата Хэммонда» в теории переходного состояния в реакциях органической химии. Также известен своим вкладом в философию науки. Лауреат Премии Норриса 1968, Медали Пристли 1976, Национальной научной медали США, Золотой Медали Отмэра 2003. Был в должности председателя Allied Chemical Corporation с 1979 по 1989 год. Хэммонд получил степень бакалавра в Бэйтс-колледже в 1943 году, степень доктора наук в Гарвардском университете в 1947 году, работал в Оксфордском университете, в Базельском университете, в Национальном научном фонде США, в Калифорнийском технологическом институте, впоследствии возглавлял в нём одновременно химический факультет и факультет химической инженерии. С 1974 по 1978 он работал начальником отдела иностранных связей в национальной академии наук США.
Химическая индукция — это явление, при котором в химической системе одна реакция ускоряет другую или вызывает протекание другой реакции, которая сама в отсутствии первой в данных условиях не идёт.
Продукты — это вещества, образующиеся в результате химических реакций. В ходе химической реакции реагенты превращаются в продукты после прохождения высокоэнергетического переходного состояния. Этот процесс приводит к поглощению реагентов. Это может быть самопроизвольная реакция или реакция, опосредованная катализаторами, снижающими энергию переходного состояния, и растворителями, создающими химическую среду, необходимую для протекания реакции. При представлении в химических уравнениях продукты обычно изображаются справа, даже в случае обратимых реакций. Свойства продуктов, такие как их энергия, помогают определить некоторые характеристики химической реакции, например, является ли реакция экзергонической или эндергонической. Кроме того, свойства продукта могут облегчить его экстракцию и очистку после химической реакции, особенно если продукт имеет другое состояние вещества, чем реагенты.









