Неоргани́ческая хи́мия — раздел химии, связанный с изучением строения, реакционной способности и свойств всех химических элементов и их неорганических соединений. Эта область охватывает все химические соединения, за исключением органических веществ. Различия между органическими и неорганическими соединениями, содержащими углерод, являются по некоторым представлениям произвольными. Неорганическая химия изучает химические элементы и образуемые ими простые и сложные вещества. Обеспечивает создание материалов новейшей техники. Число известных на 2013 г. неорганических веществ приближается к 500 тысячам.

Ба́рий — химический элемент 2-й группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 56.
Щелочны́е мета́ллы — элементы 1-й группы периодической таблицы химических элементов : литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. Гипотетический 119-й элемент унуненний в случае своего открытия, согласно строению своей внешней электронной оболочки, также будет отнесён к щелочным металлам. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
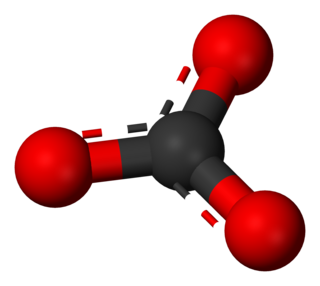
Карбона́ты — соли угольной кислоты (H2CO3), также (в органической химии) сложные эфиры угольной кислоты. Неорганические карбонаты подразделяются на средние, или просто карбонаты, содержащие анион СО32−, и кислые (гидрокарбонаты или бикарбонаты), содержащие анион НСО3−. Органические карбонаты имеют общую формулу R−O−С(O)−O−R, могут иметь ациклическое и циклическое строение.
Осно́вные гидрокси́ды — это сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (—OH) и в водном растворе диссоциируют с образованием анионов ОН− и катионов. Название основания обычно состоит из двух слов: слова «гидроксид» и названия металла в родительном падеже. Хорошо растворимые в воде основания называются щелочами.
Ацетаты — соли и эфиры уксусной кислоты. Соли — кристаллические продукты, хорошо растворимые в воде; эфиры — летучие жидкости с фруктовым и цветочным запахом. Ацетаты применяют как растворители для лаков, смол, в производстве целлулоида, в парфюмерии и пищeвой промышленности.
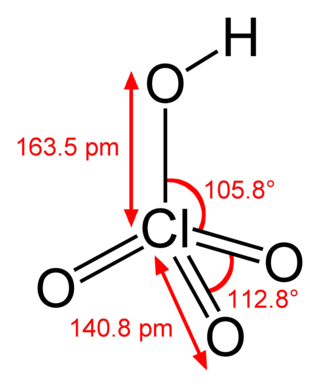
Хло́рная кислота́ (хим. формула — HClO4) — сильная одноосновная кислота.

Циани́ды — соли цианистоводородной (синильной) кислоты. В номенклатуре IUPAC к цианидам относят также C-производные синильной кислоты — нитрилы.

Мангана́ты — соли нестойких, несуществующих в свободном состоянии кислородсодержащих кислот марганца в степенях окисления V, VI и VII и содержащие тетраэдрические анионы MnO43− (гипоманганаты), MnO42− (манганаты) и MnO4− (перманганаты) соответственно.

Тетраокси́д ксено́на XeO4 — жёлтые кристаллы при температуре ниже −36 °C. XeO4 — соединение ксенона, в котором ксенон проявляет высшую степень окисления +8 (такую степень окисления ксенон может проявить только в соединении с кислородом, максимальная степень окисления со фтором равна +6, например, в гексафториде ксенона) и соответственно валентность, равную 8. Кроме него такую же степень окисления ксенон имеет в ксеноновой кислоте и её солях.

Марганцо́вая кислота́ — сильная, нестабильная, неорганическая кислота фиолетово-красного цвета с химической формулой  . В чистом виде не выделена, существует в виде раствора.
. В чистом виде не выделена, существует в виде раствора.
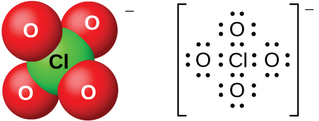
Перхлора́ты — группа химических соединений, соли или сложные эфиры хлорной кислоты. Соли металлов, неметаллов, гидразина, гидроксиламина и аммония относятся к неорганическим производным хлорной кислоты, а эфиры и соли органических соединений — к органическим производным хлорной кислоты.

Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с химической формулой Na2SO3. Белый порошок или кристаллы с солёным вкусом. Важная пищевая добавка, используемая в пищевой промышленности как консервант, антиоксидант, отбеливатель и стабилизатор цвета продуктов питания. Входит в свод международных пищевых стандартов Кодекс Алиментариус под названием E221. Помимо пищевого применения, используется также в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.

Хлорат натрия — неорганическое соединение, соль металла натрия и хлорноватой кислоты с формулой NaClO3, бесцветные кристаллы, хорошо растворимые в воде.
Фосфаты меди(II) — неорганические соединения, соли металла меди и фосфорной кислоты.

Германат натрия — неорганическое соединение, соль щелочного металла натрия и метагерманиевой кислоты с формулой Na2GeO3, бесцветные кристаллы, растворимые в воде, образует кристаллогидрат.

Сульфа́ты — соли серной кислоты H2SO4, а также (в органической химии) сложные эфиры серной кислоты —диалкилсульфаты R−O−SO2−O−R и алкилсульфаты Н−O−SO2−O−R.
Перрена́ты — класс химических соединений; соли рениевой кислоты. Содержит рений в степени окисления +7. Конечные продукты реакций окисления соединений рения, протекающих в водных растворах. В отличие от перманганатов не являются сильными окислителями, с трудом поддаются восстановлению. Бесцветные кристаллы, кроме случаев, когда цвет определяется природой катиона. Перренаты щелочных металлов перегоняются без разложения, перренат аммония при нагревании разлагается с образованием смеси оксидов рения, среди которых преобладает диоксид рения.
Селени́ты (селенаты(IV)) — класс неорганических химических соединений, соли селенистой кислоты H2SeO3. Образуются в результате взаимодействия оксида селена(IV) SeO2 или селенистой кислоты H2SeO3 с гидрокисдами, оксидами или карбонатами металлов. Селениты щелочных металлов хорошо растворимы в воде, остальные селениты — практически нерастворимы. Нерастворимые селениты получают взаимодействием растворов селенитов натрия и калия и растворов соответствующих солей металлов. Селениты щелочно-земельных и тяжёлых металлов образуют кристаллогидраты. Окисляются кислородом воздуха при нагревании до селенатов(VI), при прокаливании в инертной атмосфере разлагаются до оксидов. Входят в состав отдельных минералов, например, халькоменит, содержащий CuSeO3 · H2O.












