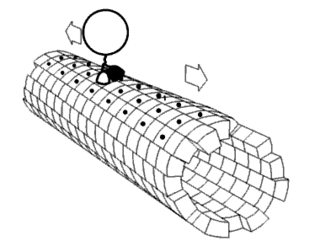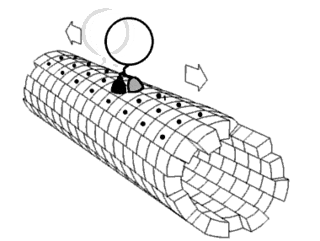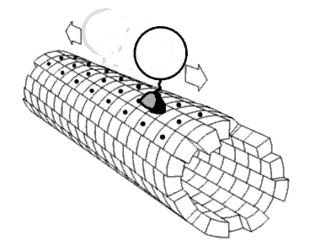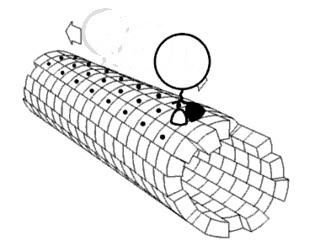
Полипролиновая спираль
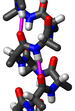
Полипролиновая спираль — это тип вторичной структуры белка, который встречается в последовательностях аминокислот, содержащих повторяющиеся остатки пролина[1]. Левозакрученная спираль полипролина II (PPII, поли-Про II) образуется, когда все последовательные аминокислотные остатки принимают двугранные углы (φ, ψ) основной цепи примерно (-75°, 150°) и имеют транс- изомеры своих пептидных связей. Эта конформация PPII также характерна для белков и полипептидов с другими аминокислотами, кроме пролина. Аналогичным образом, более компактная правозакрученная спираль полипролина I (PPI, поли-Про I) образуется, когда все последовательные остатки принимают двугранные углы (φ, ψ) основной цепи примерно (-75°, 160°) и имеют цис- изомеры своих пептидных связей. Из двадцати обычных встречающихся в природе аминокислот только пролин, вероятно, принимает цис- изомер пептидной связи, особенно пептидную связь X-Про; стерические и электронные факторы в значительной степени благоприятствуют транс- изомеру в большинстве других пептидных связей. Однако пептидные связи, которые заменяют пролин другой N- замещенной аминокислотой (такой как саркозин), также могут принимать цис- изомер.
Спираль полипролина II


Спираль PPII определяется двугранными углами (φ, ψ) основной цепи примерно (-75°, 150°) и транс- изомерами пептидных связей. Угол поворота Ω на остаток любой полипептидной спирали с транс- изомерами определяется уравнением
Подстановка двугранных углов поли-Про II (φ, ψ) в это уравнение дает почти точно Ω = −120°, то есть Спираль PPII является левозакрученной спиралью (поскольку Ω отрицательна) с тремя остатками на оборот (360°/120° = 3). Сдвиг цепи на остаток составляет приблизительно 3,1 Å. Эта структура в некоторой степени похожа на структуру волокнистого белка коллагена, который состоит в основном из пролина, гидроксипролина и глицина. Спирали PPII специфически связываются доменами SH3; это связывание важно для многих белок-белковых взаимодействий и даже для взаимодействий между доменами одного белка.
Спираль PPII является относительно открытой и не имеет внутренних водородных связей, в отличие от более распространённых спиральных вторичных структур, α-спирали и её родственников 310-спирали и π-спирали, а также β-спирали. Атомы азота и кислорода амида расположены слишком далеко друг от друга (примерно 3,8 Å) и неправильно ориентированы для образования водородных связей. Более того, оба эти атома являются акцепторами водородной связи в пролине; нет донора Н-связи из-за циклической боковой цепи.
Двугранные углы основной цепи, как у PPII (-75°, 150°), часто наблюдаются в белках, даже для аминокислот, отличных от пролина[2]. График Рамачандрана сильно заселен в области PPII, по сравнению с областью бета-листа около (-135°, 135°). Например, двугранные углы основной цепи PPII часто наблюдаются в поворотах, чаще всего в первом остатке β-поворота типа II. «Зеркальное отображение» двугранных углов основной цепи PPII (75°, −150°) наблюдается редко, за исключением полимеров ахиральной аминокислоты глицина. Аналог спирали поли-Про II в полиглицине называется спиралью поли-Гли II . Некоторые белки, такие как антифризный белок Hypogastrura harveyi, состоят из пучков богатых глицином спиралей полиглицина II[3]. Этот выдающийся белок, трехмерная структура которого известна[4] имеет уникальные спектры ЯМР и стабилизируется за счет димеризации и 28 Cα-H··O=C водородных связей[5]. Спираль PPII не характерна для трансмембранных белков, и эта вторичная структура не пересекает липидные мембраны в естественных условиях. В 2018 году группа исследователей из Германии сконструировала и экспериментально наблюдала первую трансмембранную спираль PPII, образованную специально разработанными искусственными пептидами[6][7].
Спираль полипролина I


Спираль поли-Про I намного плотнее спирали PPII из-за цис- изомеров её пептидных связей. Она также встречается реже, чем конформация PPII, потому что цис- изомер имеет более высокую энергию активации, чем транс. Её типичные двугранные углы (-75°, 160°) близки, но не идентичны углам спирали PPII. Однако спираль PPI является правозакрученной спиралью и более плотно намотана, с примерно 3,3 остатками на виток (а не 3). Сдвиг на остаток в спирали PPI также намного меньше, примерно 1,9 Å. Опять же, в спирали поли-Про I нет внутренней водородной связи как из-за отсутствия донорного атома водородной связи, так и из-за того, что амидные атомы азота и кислорода слишком удалены (снова примерно на 3,8 Å) и неправильно ориентированы.
Структурные свойства
Традиционно PPII считался относительно жесткой и использовался в качестве «молекулярной линейки» в структурной биологии, например, для калибровки измерений эффективности FRET. Однако последующие экспериментальные и теоретические исследования поставили под сомнение эту картину полипролинового пептида как «жесткого стержня»[8][9]. Дальнейшие исследования с использованием терагерцовой спектроскопии и расчетов теории функционала плотности показали, что полипролин на самом деле намного менее жесткий, чем первоначально предполагалось[10]. Взаимопревращения спиральных форм полипролина PPII и PPI происходят медленно из-за высокой энергии активации цис-транс- изомеризации X-Pro (Ea ≈ 20 ккал/моль); однако, это взаимопревращение может быть катализировано специфическими изомеразами, известными как пролилгидроксилазы изомераз или PPIases. Взаимопревращение между спиралями PPII и PPI включает изомеризацию цис-транс- пептидной связи по всей пептидной цепи. Исследования, основанные на спектрометрии ионной подвижности, показали наличие определённого набора промежуточных соединений в этом процессе[11].
См. также
Примечания
- ↑ Adzhubei, Alexei A. (2013). "Polyproline-II Helix in Proteins: Structure and Function". Journal of Molecular Biology. 425 (12): 2100—2132. doi:10.1016/j.jmb.2013.03.018. ISSN 0022-2836. PMID 23507311.
- ↑ Adzhubei, Alexei A. (1993). "Left-handed Polyproline II Helices Commonly Occur in Globular Proteins". Journal of Molecular Biology. 229 (2): 472—493. doi:10.1006/jmbi.1993.1047. ISSN 0022-2836. PMID 8429558.
- ↑ Davies, Peter L. (2005-10-21). "Glycine-Rich Antifreeze Proteins from Snow Fleas". Science (англ.). 310 (5747): 461. doi:10.1126/science.1115145. ISSN 0036-8075. PMID 16239469.
- ↑ Pentelute, Brad L. (2008-07-01). "X-ray Structure of Snow Flea Antifreeze Protein Determined by Racemic Crystallization of Synthetic Protein Enantiomers". Journal of the American Chemical Society. 130 (30): 9695—9701. doi:10.1021/ja8013538. ISSN 0002-7863. PMID 18598029.
- ↑ Treviño, Miguel Ángel (2018-11-15). "The Singular NMR Fingerprint of a Polyproline II Helical Bundle". Journal of the American Chemical Society (англ.). 140 (49): 16988—17000. doi:10.1021/jacs.8b05261. PMID 30430829.
- ↑ Kubyshkin, Vladimir (2018). "Transmembrane Polyproline Helix". The Journal of Physical Chemistry Letters (англ.). 9 (9): 2170—2174. doi:10.1021/acs.jpclett.8b00829. PMID 29638132.
- ↑ Kubyshkin, Vladimir (2019). "Bilayer thickness determines the alignment of model polyproline helices in lipid membranes". Physical Chemistry Chemical Physics (англ.). 21 (40): 22396—22408. Bibcode:2019PCCP...2122396K. doi:10.1039/c9cp02996f. PMID 31577299.
- ↑ S. Doose, H. Neuweiler, H. Barsch, and M. Sauer, Proc. Natl. Acad. Sci. USA. 104, 17400 (2007)
- ↑ M. Moradi, V. Babin, C. Roland, T. A. Darden, and C. Sagui, Proc. Natl. Acad. Sci. USA. 106, 20746 (2009)
- ↑ M. T. Ruggiero, J. Sibik, J. A. Zeitler, and T. M. Korter, Agnew. Chemie. Int. Ed. 55, 6877 (2016)
- ↑ El-Baba, Tarick J. (2019). "Solvent Mediation of Peptide Conformations: Polyproline Structures in Water, Methanol, Ethanol, and 1-Propanol as Determined by Ion Mobility Spectrometry-Mass Spectrometry". Journal of the American Society for Mass Spectrometry (англ.). 30 (1): 77—84. Bibcode:2019JASMS..30...77E. doi:10.1007/s13361-018-2034-7. PMID 30069641.