Посттрансляционная модификация
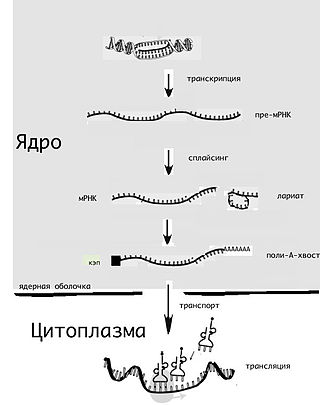
Посттрансляционная модификация — это ковалентная химическая модификация белка после его синтеза на рибосоме. Для многих белков посттрансляционная модификация оказывается завершающим этапом биосинтеза, который является частью процесса экспрессии генов. Наряду с альтернативным сплайсингом посттрансляционные модификации увеличивают разнообразие белков в клетке.
На сегодняшний день известно более двухсот вариантов посттрансляционной модификации белков, и, по всей видимости, модификациям подвергается подавляющее большинство белков[2], более того, один и тот же белок может подвергаться нескольким различным модификациям. Посттрансляционные модификации оказывают различные эффекты на белки: регулируют продолжительность их существования в клетке, ферментативную активность, взаимодействия с другими белками. В ряде случаев посттрансляционные модификации являются обязательным этапом созревания белка, в противном случае он оказывается функционально неактивным. Например, при созревании инсулина и некоторых других гормонов необходим ограниченный протеолиз полипептидной цепи, а при созревании белков плазматической мембраны — гликозилирование.
Посттрансляционные модификации могут быть как широко распространёнными, так и редкими, вплоть до уникальных. Так, гликозилирование является одной из наиболее часто встречающихся модификаций: считается, что около половины белков человека гликозилировано, а 1—2 % генов человека кодируют белки, связанные с гликозилированием[3]. К редким модификациям относят тирозинирование/детирозинирование и полиглицилирование тубулина[4].
Исключительное значение посттрансляционных модификаций для нормального функционирования организма подтверждается тем, что существуют заболевания, в основе которых лежит нарушение системы посттрансляционной модификации белков (муколипидоз, болезнь Альцгеймера, различные виды рака). На сегодняшний день для изучения посттрансляционной модификации применяют методы масс-спектрометрии и истерн-блоттинга.
Модификации главной цепи
Модификации главной цепи, включающие расщепление пептидной связи:
- удаление N-концевого остатка метионина,
- ограниченный протеолиз.
Присоединение небольших химических групп:
Присоединение гидрофобных групп для локализации в мембране:
- N-миристоилирование,
- присоединение гликозилфосфатидилинозитола (GPI).
Модификации боковых цепей аминокислот
Присоединение или отщепление небольших химических групп:
- гликозилирование,
- N-гликозилирование,
- O-гликозилирование,
- гидроксилирование,
- ацетилирование,
- метилирование,
- γ-карбоксилирование,
- O-сульфонирование,
- фосфорилирование,
- йодирование,
- окисление,
- гликирование,
- образование ковалентных связей с другими аминокислотами (обычно это дисульфидные связи, но бывают и другие[5]),
- деиминирование,
- карбомоилирование,
- дезамидирование.
Присоединение гидрофобных групп для локализации в мембране:
- пренилирование — присоединение остатков изопреноидов (фарнезила и геранилгеранила),
- S-пальмитирование.
Присоединение других белков и пептидов:
- убиквитинирование —присоединение убиквитина,
- сумоилирование — присоединение белка SUMO.
Примечания
- ↑ Gramatikoff K. in Abgent Catalog (2004-5) p.263
- ↑ Jensen, O. N. Interpreting the protein language using proteomics (англ.) // Nat Rev Mol Cell Biol : journal. — 2006. — Vol. 7. — P. 391—403. — doi:10.1038/nrm1939. — PMID 16723975.
- ↑ Walsh, G. and Jefferis, R. Post-translational modifications in the context of therapeutic proteins (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2006. — Vol. 24. — P. 1241—1252. — doi:10.1038/nbt1252. — PMID 17033665.
- ↑ Rosenbaum, J. Cytoskeleton: functions for tubulin modifications at last (англ.) // Curr Biol : journal. — 2000. — Vol. 10. — P. 801—803. — doi:10.1016/S0960-9822(00)00767-3. — PMID 11084355.
- ↑ у цитохромоксидазы гистидин через свой атом азота ковалентно связан с мета-углеродом бензольного кольца тирозина
См. также
Ссылки
- Post Translational Modification
- Prediction of human protein function from post-translational modifications and localization features, L.J. Jensen, R. Gupta, N. Blom, D. Devos, J. Tamames, C. Kesmir, H. Nielsen, H.H. Stærfeldt, K. Rapacki, C. Workman, C. A. F. Andersen, S. Knudsen, A. Krogh, A. Valencia, S. Brunak, J. Mol. Biol., 319, 1257—1265, 2002.