Почка млекопитающего
| Почка млекопитающего | |
|---|---|
![Однососочковая многодолевая гладкая почка верблюда бобовидной формы, у которой почечные сосочки полностью объединены в почечный гребешок[1]](https://upload.wikimedia.org/wikipedia/commons/thumb/2/29/Camel_kidney_%28longitudinal_cut%29.-_FMVZ_USP-30.jpg/268px-Camel_kidney_%28longitudinal_cut%29.-_FMVZ_USP-30.jpg) Однососочковая многодолевая гладкая почка верблюда бобовидной формы, у которой почечные сосочки полностью объединены в почечный гребешок[1] | |
| Система | Выделительная система, эндокринная система |
| Кровоснабжение | Почечная артерия |
| Венозный отток | Почечная вена |
Почка млекопитающего — парный орган мочевыделительной системы млекопитающих, являющийся разновидностью метанефрической почки[2]. Почка у млекопитающих обычно бобовидной формы[3], расположена забрюшинно[4] на задней (дорсальной) стенке тела[5]. Каждая почка состоит из фиброзной оболочки, периферического коркового вещества, внутреннего мозгового вещества, а также чашек и почечной лоханки, однако чашечки или почечная лоханка у отдельных видов могут отсутствовать. Выводится моча из почки через мочеточник[5]. Строение почки может различаться между видами в зависимости от среды обитания, в частности от её засушливости[6]. За фильтрацию крови ответственно корковое вещество, по своей сути оно аналогично типичным почкам менее развитых позвоночных[5]. Азотсодержащие продукты жизнедеятельности выделяются почками у млекопитающих преимущественно в виде мочевины[7].
В зависимости от вида почки могут быть однодолевыми или многодолевыми, однососочковыми, с несколькими сосочками или многососочковыми[8], могут быть с гладкой поверхностью или бороздчатыми[1][9], также почки могут быть множественными, множественные встречаются в основном у морских млекопитающих[10]. Наиболее простым типом почки у млекопитающих является однососочковая однодолевая почка[11][4]. Различия в структуре почек являются результатом адаптации в ходе эволюции к различной массе тела и среде обитания[12][13]. К почкам млекопитающих относятся почки человека.
Корковое и мозговое вещество почек содержит в себе нефроны[14]. У млекопитающих нефроны разделяются на нефроны с короткой и с длинной петлёй Генле[15], ответственной за концентрацию мочи[16]. Среди позвоночных вырабатывать концентрированную мочу могут только почки млекопитающих и птиц[5], но лишь у млекопитающих петлю Генле содержат все нефроны[17].
Почки млекопитающих являются жизненно-важными органами[18], которые поддерживают водно-электролитный и кислотно-щелочной баланс в организме, выводят азотистые продукты жизнедеятельности, регулируют артериальное давление, участвуют в формировании костей[19][20][21] и в поддержании гомеостаза глюкозы[22]. В почках происходят процессы фильтрации плазмы крови, канальцевой реабсорбции и канальцевой секреции, в результате этих процессов формируется моча[23]. Из числа гормонов в почках вырабатываются ренин[24] и эритропоэтин[25], также почки участвуют в преобразовании витамина D в его активную форму[26]. При этом млекопитающие являются единственным классом позвоночных, у которого за поддержание гомеостаза внеклеточной жидкости в организме отвечают одни лишь почки[27]. Регулируется деятельность почек вегетативной нервной системой и гормонами[28].
Почки могут быть подвержены неинфекционным и инфекционным заболеваниям, в редких случаях в почках млекопитающих встречаются врождённые и наследственные аномалии[29]. Причиной пиелонефрита обычно являются бактериальные инфекции[30][31]. Некоторые заболевания могут быть специфичными для видов[32], у некоторых видов распространены паразитарные заболевания почек[33][34]. В силу особенностей устройства у млекопитающих почки склонны к ишемическим и токсическим повреждениям[35]. Возможности регенерации в зрелых почках ограничены[36][37], поскольку новые нефроны не образуются[38], однако в случае ограниченных повреждений функция почек может быть восстановлена за счёт компенсационных механизмов[39]. Постоянные повреждения могут приводить к хронической болезни почек[40][41]. В процессе старения почки также претерпевают изменения, в них снижается количество функционирующих нефронов[42].
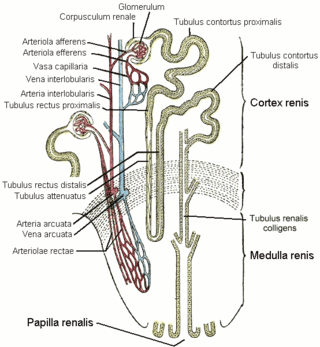
Структура
Расположение и форма

- 1. Фиброзная капсула
- 2. Корковое вещество
- 3. Почечная пирамида мозгового вещества
- 4. Почечный столб коркового вещества
- 5. Нефрон
- 6. Почечный сосочек
- 7. Малая почечная чашка
- 8. Большая почечная чашка
- 9. Почечная лоханка
- 10. Мочеточник
- 11. Почечная артерия
- 12. Почечная вена
- 13. Междолевая артерия
- 14. Почечная доля
- 15. Дуговая артерия
- 16. Междольковая артерия
У млекопитающих почки обычно бобовидной формы[3], такая форма свойственна только млекопитающим[44]. Располагаются забрюшинно[4] на задней (дорсальной) стенке тела[45]. Одним из ключевых факторов, которые определяют форму и морфологию почек у млекопитающих является их масса[46]. Вогнутая часть бобовидных почек называется почечными воротами. В них в почку входят почечная артерия и нервы, а выходят почечная вена, лимфатические сосуды и мочеточник[4][47]. Снаружи почка окружена массой жировой ткани[48].
Общее строение
Внешний слой каждой из почек состоит из фиброзной оболочки, называемой капсулой. Периферический слой почки представлен корковым веществом, а внутренний — мозговым. Мозговое вещество состоит из пирамид, восходящих своим основанием к корковому веществу и образующих вместе с ним почечную долю[49]. Пирамиды между собой разграничиваются почечными столбами (столбами Бертена), образованными корковой тканью[50]. Вершины пирамид оканчиваются почечными сосочками, из которых моча выводится в чашечки, в лоханку, мочеточник и мочевой пузырь[49][51], после чего она выводится наружу через мочеиспускательный канал[52].
Паренхима

- 1. Корковое вещество
- 2. Наружная зона мозгового вещества
- 3. Внутренняя зона мозгового вещества
- 4. Внутренняя полоса наружной зоны мозгового вещества
- 5. Наружная полоса наружной зоны мозгового вещества
- 6. Юкстамедуллярный нефрон
- 7. Мозговой луч
- 8. Почечная капсула
- 9. Почечный сосочек.
Подоциты Проксимальный извитой каналец Проксимальный прямой каналец Промежуточный каналец (петля Генле) Дистальный прямой каналец Macula densa (плотное пятно) Дистальный извитой каналец Соединительный каналец Собирательна трубочка
Паренхима, будучи функциональной частью почек, визуально делится на корковое и мозговое вещество[54][55]. В основе коркового и мозгового вещества лежат нефроны[56][57] в совокупности с разветвлённой сетью кровеносных сосудов и капилляров, а также собирательные трубочки, в которые нефроны впадают, собирательные протоки и почечный интерстиций[58]. В корковом веществе расположена фильтрующая кровь часть нефрона — почечное тельце, от которого внутрь спускается почечный каналец, переходящий в мозговом веществе в петлю Генле, затем каналец возвращается назад в корковое вещество и своим дистальным концом впадает в общую для нескольких нефронов собирательную трубочку. Собирательные трубочки спускаются снова в мозговое вещество и объединяются в собирательные протоки, проходящие через внутреннее мозговое вещество[59][60].
По расположению почечных клубочков нефроны делятся на 3 типа: субкапсулярные (ближе к капсуле), интраконтикальные (в средней части) и юкстамедуллярные (ближе к мозговому веществу). По длине петли Генле — на нефроны с длинной петлёй и с короткой петлёй Генле[61]. Соотношение коркового к мозговому веществу варьируется между видами, у одомашненных животных корковое вещество обычно занимает третью или четвёртую часть толщины паренхимы, в то время как у пустынных животных с длинными петлями Генле — лишь пятую часть[9].
Корковое вещество
Структурно корковое вещество состоит из коркового лабиринта и мозговых лучей[62]. Корковый лабиринт содержит в себе междольковые артерии, сосудистые сети, образованные афферентными и эфферентными артериолами, почечные тельца, проксимальные извитые канальцы, плотные пятна (лат. macula densa), дистальные извитые канальцы, соединительные канальцы и начальные части собирательных трубочек[63]. Преобладают в корковом лабиринте проксимальные извитые канальцы[64]. Сплошной слой коркового вещества, лежащий над мозговыми лучами, называется корой коркового вещества (лат. cortex corticis)[62]. У некоторых млекопитающих есть нефроны, петли Генли которых не достигают мозгового вещества, такие нефроны называются корковыми[59]. Мозговые лучи коркового вещества содержат в себе проксимальные прямые канальцы, корковую часть восходящих толстых ветвей петли Генле и корковую часть собирательных трубочек[63]. При этом корковое вещество делится на дольки, каждая из которых представляет из себя мозговой луч в совокупности с ассоциированными с ним нефронами, а между дольками проходят междольковые артерии[65].
Мозговое вещество
Мозговое вещество у млекопитающих делится на наружную и внутреннюю зоны. Наружная зона состоит из коротких петлей Генле и собирательных трубочек, внутренняя — из длинных петлей и собирательных протоков[66]. Наружная зона, в свою очередь, также подразделяется на наружную[67] (лежащую прямо под корковым веществом)[68] и внутреннюю полосы[67]. Отличаются полосы тем, что в наружной присутствуют проксимальные прямые канальцы, а во внутренней — тонкие нисходящие части петли Генле (отдел нефрона, следующий за проксимальным прямым канальцем)[68].
Соотношение наружного и внутреннего мозгового вещества
У большинства видов есть нефроны и с короткими, и с длинными петлями, у отдельных же видов может быть лишь один тип. Например, у горных бобров есть только нефроны с короткой петлёй, и, соответственно, отсутствует внутреннее мозговое вещество. У собак и кошек, наоборот, есть только нефроны с длинными петлями. Соотношение нефронов с короткими петлями Генле к нефронам с длинными также варьируется между видами[69].
Структурные различия между видами

Структурно почки варьируются между млекопитающими[70]. То, какой структурный тип будет у того или иного вида, в основном зависит от массы тела животных[71]. У маленьких млекопитающих встречаются простые однодолевые почки с компактной структурой и одним почечным сосочком[70][72], в то время как у больших животных — почки многодолевые, как например, у крупного рогатого скота[70][73], при этом у крупного рогатого скота почки бороздчатые, визуально поделённые на доли[9]. Сама по себе доля равноценна простой однососочковой почке, как у крыс или мышей[64]. У крупного рогатого скота также отсутствует почечная лоханка, моча из больших чашек выводится напрямую в мочеточник[74].
По количеству почечных сосочков почки могут быть однососочковыми[75], как например у крыс и мышей[76], с несколькими почечными сосочками, как у паукообразных обезьян, или с большим количеством, как у свиней и человека[75]. У большинства животных один почечный сосочек[75]. У некоторых животных, например, у лошадей, окончания почечных пирамид сливаются друг с другом с образованием общего почечного сосочка, называемого почечным гребнем[77]. Почечный гребень обычно появляется у животных, размером больше кролика[78].

- 1. Почечная артерия
- 2. Почечная вена
- 3. Общий собирательный проток, переходящий в мочеточник.
У морских млекопитающих, выдр и медведей почки множественные, состоящие из маленьких почечек[10], каждая из которых аналогична простой однодолевой почке[62]. Почки морских млекопитающих могут состоять из сотен[10] или тысяч[41] почечек, у каждой из которых свои корковое и мозговое вещество и чашечка[10]. Например, у китов порядка 7000 объединённых общей собирательной системой почечек[41]. У ламантин, тоже являющихся морскими млекопитающими, фактически почки многодолевые, поскольку корковое вещество сплошное[10].
Размеры почек увеличиваются с массой млекопитающих, а количество нефронов в почках между млекопитающими возрастает алометрически[80]. У мышей почки длиной примерно 1 см, массой 400 мг, c 16 000 нефронов, в то время как у косатки длина почки превышает 25 см, масса составляет примерно 4,5 кг, с количеством нефронов порядка 10 000 000. При этом почки косаток множественные, а каждая почечка сравнима с почкой мышей (длина почечки составляет 1 см, масса — примерно 430 мг)[81].
Микроанатомия
С точки зрения микроанатомии почку структурно можно разделить на несколько основных элементов: почечные тельца, канальцы, интерстиций и сосудистую сеть[9]. Интерстиций представляет собой клетки и внеклеточный матрикс в пространстве между клубочками, сосудами, канальцами и трубочками[82][83]. Пространство интерстиция, окружающее клетки, заполнено тканевой жидкостью[84]. Интерстиций между канальцами содержит в себе дендритные клетки, макрофаги, лимфоциты и фибробласты. В корковом веществе он включает в себя эндотелиальные клетки лимфатических капилляров[84], которые считаются частью интерстиция из-за отсутствия базальной мембраны[85]. Интерстициальные фибробласты формируют каркас тканей почки[86]. Через интерстиций проходят кровеносные сосуды, нервы и лимфатические сосуды[87]. Каждый нефрон с продолжающей его собирательной трубочкой и снабжающая нефрон сосудистая сеть встроены в интерстиций. Нефрон вместе с продолжающей его собирательной трубочкой называется мочевым канальцем (англ. uriniferous tubule)[9].
В почках млекопитающих описаны порядка 18—26 различных типов клеток, при этом большой разброс диапазона обусловлен отсутствием консенсуса по тому, что считать отдельным видом клеток, и вероятно, межвидовыми различиями[88]. Почечные тельца состоят из 4 типов клеток: фенестрированного эндотелия, мезангиальных клеток, подоцитов и париетальных эпителиальных клеток капсулы Боумена[89]. По крайней мере из 16 различных типов клеток состоят почечные канальцы[90]. Сами канальцы поделены на по крайней мере 14 сегментов[90], которые различаются типами клеток и функциями[91]. Нормальное функционирование почек обеспечивается всей совокупностью эпителиальных, эндотелиальных, интерстициальных и иммунных клеток[92].
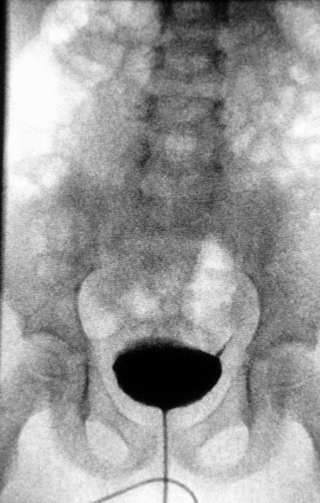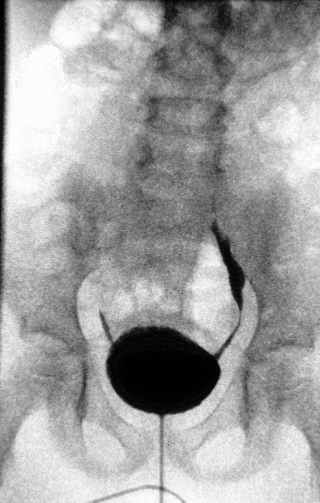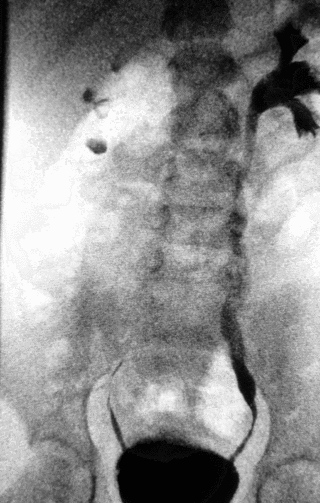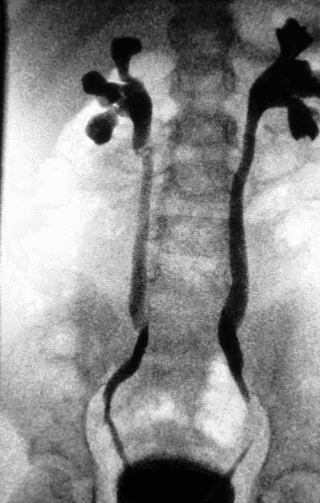
Кровоснабжение

Кровь поступает в почку через почечную артерию[47], которая в многодолевой почке затем разветвляется в области почечной лоханки на крупные междолевые артерии, проходящие по почечным столбам[51][93][51]. Междолевые артерии, в свою очередь, ветвятся у основания пирамиды, давая начало дуговым, от которых в корковое вещество отходят междольковые артерии[93]. Междолевые артерии снабжают пирамиды и прилегающее корковое вещество разветвлённой сетью кровеносных сосудов[51]. Само корковое вещество сильно пронизано артериями, в то время как в мозговом веществе артерии отсутствуют[11]. Венозный отток крови идёт обратно параллельно артериям[93]. У некоторых видов в корковом веществе под капсулой формируются сплетения из обособленных от артерий вен, которые у человека называются звёздчатыми, впадают эти вены в междольковые вены[94]. Почечно-портальная система кровообращения[англ.] у млекопитающих отсутствует[95], за исключением однопроходных[96]. Млекопитающие являются единственным классом позвоночных (за исключением некоторых видов), у которых нет почечно-портальной системы[97].
Сосудистые клубочки нефронов получают кровь от афферентных артериол, которые, в свою очередь, берут начало в междольковых артериях с промежуточным формированием преартериол. От каждой афферентной артериолы отходит несколько почечных клубочков. Затем эти клубочки переходят в эфферентную артериолу, в которую от нефронов поступает отфильтрованная кровь. У нефронов с длинной петлёй Генле эфферентные артериолы разветвляются, формируя прямые сосуды[англ.] (лат. vasa recta), нисходящие в мозговое вещество. Восходящие прямые сосуды, нисходящие прямые сосуды и петля Генле в совокупности формируют противоточную систему почки. В афферентную артериолу кровь подаётся под высоким давлением, что способствует фильтрации, а в эфферентной она оказывается под низким давлением, что способствует реабсорбции[93].
Несмотря на небольшие размеры, на почки млекопитающих приходится значимая часть минутного объёма кровообращения[98]. Считается, что у сухопутных млекопитающих через почки проходит примерно пятая часть объёма крови, который проходит через сердце[99]. У взрослых мышей, например, этот показатель составляет 9 %—22 %[100].
Лимфатическая система
Почка достаточно хорошо снабжена лимфатическими сосудами[101], которые удаляют из заполняющего пространство между канальцами и кровеносными сосудами интерстиция излишнюю жидкость, растворённые в ней вещества и макромолекулы[102][103]. Анатомия лимфатический системы почки между млекопитающими схожа[104]. Лимфатические сосуды в основном повторяют путь кровеносных[105].
Начинается лимфатическая система почек в корковом веществе с начальных внутридольковых лимфатических капилляров, проходящих вблизи канальцев и почечных телец, но при этом лимфатические сосуды не заходят внутрь почечных телец. Далее внутридольковые лимфатические капилляры соединяются с дуговыми лимфатическими сосудами[106]. Дуговые переходят в междолевые, которые проходят вблизи междолевых артерий[106][104]. Дуговые и междолевые лимфатические сосуды являются лимфатическими преколлекторами[85]. Наконец, междолевые переходят в собирательные лимфатические сосуды почечных ворот, выходящие из почки[106]. В мозговом веществе лимфатические сосуды у млекопитающих обычно не присутствуют, а роль лимфатических сосудов берут на себя прямые сосуды[англ.] (лат. vasa recta)[107][108].
У отдельных видов могут быть отличия в анатомии лимфатической системы почки. Например, у овец отсутствуют лимфатические сосуды в почечной капсуле, а у кроликов отсутствуют междольковые лимфатические сосуды[106]. Что касается мозгового вещества, в большинстве исследований не удаётся обнаружить лимфатические сосуды в мозговом веществе почек животных, в частности, они не обнаружены у овец и крыс. Отдельные исследования обнаружили лимфатические сосуды в мозговом веществе почек свиней и кроликов[108]. В зависимости от вида может также быть или не быть соединение между лимфатическими сосудами почечной капсулы и почечной лимфатической системой[109].
Снабжение нервами
Иннервация почки обеспечивается входящими в почку через почечные ворота[47] эфферентными симпатическими нервными волокнами, берущими своё начало в солнечном сплетении[110][111], и афферентными, выходящими из почки к спинальному ганглию[110]. Достоверных доказательств иннервации почки парасимпатическими нервами нет[110], существующие же свидетельства являются спорными[112]. Эфферентные симпатические нервные волокна достигают сосудистой системы почки, почечных канальцев, юкстагломерулярных клеток и стенки почечной лоханки[113], при этом все части нефрона иннервируются симпатическими нервами[110]. Проходят нервные волокна внутри соединительной ткани, расположенной вокруг артерий и артериол. В мозговом веществе нисходящие прямые сосуды (лат. vasa recta) иннервируются до тех пор, пока они содержат в себе гладкомышечные клетки[114]. Большинство афферентных нервных волокон расположены в области почечной лоханки[115]. Подавляющая часть нервов в почках являются немиелинизированными[116].
Нормальная физиологическая стимуляции эфферентных симпатических нервов почки участвует в поддержании баланса воды и натрия в организме. Активация эфферентных симпатических нервов почки снижает в ней кровоток, соответственно, фильтрацию и выведение с мочой натрия, а также увеличивает скорость секреции ренина[117]. Афферентные нервы в почке также участвуют в поддержании баланса. Механочувствительные нервы почки активируются растяжением ткани почечной лоханки, что может произойти при увеличении скорости потока мочи из почки, в результате чего рефлекторно снижается активность эфферентных симпатических нервов. То есть активация афферентных нервов в почке подавляет активность эфферентных[118].
Функции
Выделительная функция
У млекопитающих азотистые продукты метаболизма выводятся преимущественно в форме мочевины[7], которая является конечным продуктом метаболизма млекопитающих[119] и хорошо растворима в воде[120]. Мочевина образуется преимущественно в печени в качестве побочного продукта метаболизма белков[121]. Большая часть мочевины выводится именно почками[119]. Фильтрация крови, как и у других позвоночных происходит в почечных клубочках, где кровь под давлением проходит через проницаемый барьер, который отфильтровывает клетки крови и большие белковые молекулы, образуя первичную мочу. Отфильтрованная первичная моча осмотически и по содержанию ионов такая же, что и плазма крови. В канальцах нефрона происходит последующее повторное всасывание полезных для организма веществ, растворённых в первичной моче, и концентрация мочи[122].
Осморегуляция
Почки млекопитающих поддерживают почти неизменный уровень осмолярности плазмы крови. Основной составляющей плазмы крови, определяющей её осмолярность являются натрий и его анионы[123]. Ключевую роль в поддержании постоянного уровня осмолярности играет контроль соотношения натрия и воды в крови[123][124]. Потребление большого количества воды способно разбавить плазму крови, в этом случае почки вырабатывают более разбавленную мочу по сравнению с плазмой, чтобы оставить соль в крови, но вывести излишки воды. Если же воды потребляется слишком мало, то моча выводится более концентрированной, чем плазма крови[123]. Концентрация мочи обеспечивается осмотическим градиентом, который увеличивается от границы между корковым и мозговым веществом до вершины мозговой пирамиды[123].
Помимо почек в регулировании баланса воды участвуют гипоталамус и нейрогипофис посредством системы обратной связи. Осморецепторы гипоталамуса реагируют на повышение осмолярности плазмы крови, в результате чего стимулируется секреция вазопрессина задней долей гипофиза, а также возникает жажда. Почки посредством рецепторов реагируют на увеличение уровня вазопрессина повышением реабсорбции воды, в результате чего осмолярность плазмы снижается за счёт её разбавления водой[125].
Варьирование количества выводимой воды является важной в плане выживания функцией для млекопитающих, у которых доступ к воде ограничен[123]. Особенностью почек млекопитающих являются петли Генле, они представляют собой наиболее эффективный способ реабсорбции воды и создания концентрированной мочи, что позволяет сохранять воду в организме[126]. После прохождения петли Генле жидкость становится гипертонической по отношению к плазме крови[127]. Почки млекопитающих сочетают в себе нефроны с короткой и с длинной петлёй Генле[128]. Способность концентрации мочи определяется главным образом структурой мозгового вещества и длиной петель Генле[129].
Эндокринная функция
Помимо выделительной, почки также выполняют эндокриную функцию, то есть вырабатывают некоторые гормоны. В юкстагломерулярных клетках почек вырабатывается ренин, являющийся ключевым регулятором ренин-ангиотензиновой системы, которая отвечает за регулирование кровяного давления[130].
Выработка эритропоэтина почками отвечает за дифференцирование клеток-предшественников эритроидного ряда в костном мозге в эритроциты и индуцируется гипоксией. Таким образом при недостатке кислорода повышается количество красных кровяных телец в крови, которые отвечают за перенос кислорода[131].
Почки участвуют в метаболизме витамина D. В печени витамин D преобразуется в кальцифедиол[англ.] (25OHD), почки же преобразуют кальцифедиол в кальцитриол (1,25(OH)2D), который является активной формой витамина и по своей сути является гормоном. Витамин D участвует в формировании костей и хрящевой ткани, а также выполняет ряд других функций, например, участвует в работе иммунной системы[26].
Регуляция кровяного давления
Некоторые внутренние органы млекопитающих, включая почки и лёгкие, рассчитаны на функционирование в пределах нормального уровня кровяного давления и нормального уровня объёма крови, а само кровяное давление также зависит от изменений уровня объёма крови. Поэтому поддержание постоянства объёма крови для млекопитающих является очень важной функцией организма[132]. На постоянство объёма крови оказывают влияние скорость клубочковой фильтрации, работа отдельный частей нефрона, симпатическая нервная система и ренин-ангиотензин-альдостероновая система[133].
В стенках афферентных артериол, у входа в почечные клубочки, расположены юкстагломерулярные клетки. Эти клетки являются чувствительными к изменению минутного объёма кровообращения, к составу и объёму внеклеточной жидкости, вырабатывая в ответ на изменения ренин[134]. Попадая в кровоток, ренин преобразует ангиотензиноген в ангиотензин I. Ангиотензин I далее расщепляется ангиотензинпревращающим ферментом до ангиотензина II, который является сильным сосудосуживающим средством, повышающим кровяное давление[134]. Помимо ангиотензина II у млекопитающих могут образовываться и другие биологически активные вещества. Ангиотензин II может расщепляться до ангиотензина III, ангеотензина IV и ангиотензина (1—7)[135].
Кислотно-щелочной баланс
Поддержка кислотно-щелочного баланса является жизненно важной функцией, поскольку изменения в уровне pH влияют практически на все биологические процессы организма[136]. У типичного млекопитающего нормальный уровень pH в среднем равен 7,4, повышенный уровень называется алкалозом, а пониженный — ацидозом[137]. Как и в случае других позвоночных у млекопитающих кислотно-щелочной баланс поддерживается главным образом бикарбонатной буферной системой (HCO3-/CO2), которая позволяет поддерживать постоянный уровень pH крови и внеклеточной жидкости[138]. Данная буферная система описывается следующим уравнением[139]:
HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
Регулирование кислотно-щелочного баланса посредством бикарбонатной буферной системы обеспечивается работой лёгких и почек[138]. Лёгкие регулируют уровень CO2 (углекислого газа), а почки — уровень HCO3- и H+ (ионов водорода и гидрокарбоната)[139]. При этом почки играют ключевую роль в поддержании постоянного уровня кислотно-щелочного баланса у млекопитающих[21]. В почечных клубочках HCO3- полностью фильтруется в первичную мочу[139]. Для поддержания постоянного уровня pH почки реабсорбируют обратно в кровоток почти весь HCO3- и секретируют в мочу H+, таким образом, происходит окисление мочи[140].
Реабсорбция HCO3- происходит в проксимальном канальце, в восходящей части петли Генле и в меньшей степени в дистальном извитом канальце нефрона. Секреция H+ выполняется в основном посредством Na+/H+-обменников в канальцах нефрона[140]. Собирательные трубочки участвуют в энергозависимой секреции H+[141]. При попадании ионов H+ в мочу они могут соединяться с отфильтрованным HCO3- с образованием угольной кислоты H2CO3, которая распадается на CO2 и H2O (воду) под действием люминальной карбоангидразы. Образовавшийся CO2 диффундирует в клетки канальцев, где он при участии цитозольной карбоангидразы соединяется с H2O и снова образует HCO3-, который затем возвращается в кровоток, а образовавшийся ион H+ секретируется в мочу. Часть ионов H+ секретируется с затратами энергии посредством АТФ-зависимого механизма[140].
Выводимая моча является слабокислой. Выделение H+ вместе с мочой также происходит посредством буферных систем, в частности, NH4+ (аммония)[142]. Лишь небольшое количество NH4+ фильтруется через клубочки[142], основная часть выводимого аммония является результатом окисления ионами H+ образующегося в клетках проксимального извитого канальца NH3 (аммиака), который секретируется в просвет канальца как NH3 или как NH4+[143]. Образование аммиака также сопровождается образованием нового HCO3-, который пополняет буферную систему крови[143]. В толстом восходящем канальце петли Генли, наоборот, происходит всасывание NH4+, который затем перемещается в интерстиций[144]. Окончательный этап окисления мочи происходит в собирательных трубочках, в которых с задействованием АТФ секретируются ионы H+, а из интерстиция транспортируется и секретируется NH3, который окисляется H+ с образованием NH4+[141]. За счёт регулирования реабсорбции HCO3- и секреции H+ почки помогают поддерживать гомеостаз pH крови[139].
Гомеостаз глюкозы
Наряду с печенью[145], почки участвуют в поддержании гомеостаза глюкозы в организме[22][146]. В почках происходят процессы фильтрации, реабсорбции и потребления глюкозы, а также производство глюкозы посредством глюконеогенеза[22][146]. Потребление глюкозы (гликолиз) происходит преимущественно в мозговом веществе, глюконеогенез же происходит в корковом веществе[22]. Гормонально процесс глюконеогенеза в почках регулируется с помощью инсулина и катехоламинов[22].
Эволюция
Возникновение у млекопитающих
Считается, что первые млекопитающие появились в Пермском периоде, который характеризуется холодными ночами в засушливых пустынях и выраженной сезонностью с длинными холодными зимами. Вероятно, холод и засушливость в те времена были значимыми факторами эволюционного давления. Развитие теплокровности у предшественников млекопитающих могло привести к увеличению интенсивности циркуляции крови, и, соответственно, к повышению артериального давления, которое, в свою очередь, увеличивало скорость клубочковой фильтрации почек. Однако увеличение скорости клубочковой фильтрации повлекло бы за собой и увеличение скорости вывода воды из организма[147]. За концентрацию мочи и реабсорбцию воды отвечает тонкий сегмент канальца, являющийся частью петли Генле и присутствующий у всех млекопитающих[148]. Можно предположить, что развитие механизма реабсорбции воды могло быть частью перехода к теплокровности, нежели прямой адаптацией к засушливости[147].
Адаптации к засушливости
Способность создавать более концентрированную мочу обратно зависит от массы тела животного, то есть чем меньше масса млекопитающего, тем более концентрированную мочу по отношению к животным с большей массой его почки могли бы производить в ходе адаптации к засушливому климату[149]. Некоторые животные, обитающие в пустыне, эволюционно развили способность к куда большей концентрации мочи, чем у других животных[150]. Наиболее концентрированную мочу среди изученных видов производит австралийская тушканчиковая мышь Notomys alexis[149], в почках которой более длинные по сравнению с почками других млекопитающих петли Генли и удлинённый почечный сосочек[151]. Более длинные петли у австралийских тушканчиковых мышей позволяют создавать очень концентрированную мочу[126] и выживать в условиях недостатка воды[149]. Исследования также показали, что эволюция концентрации мочи у разных пустынных млекопитающих была конвергентной[149].
Адаптации к увеличению массы
Самым простым типом почек у млекопитающих является однососочковая однодолевая почка, состоящая из коркового вещества, мозгового вещества и почечной лоханки[152]. Однако однодолевая почка имеет некоторый верхний предел по количеству нефронов, при котором она работает оптимальным образом[13]. Предположительно, именно этот тип почек мог у млекопитающих быть изначальным, от которого в ходе эволюции произошли многодолевые почки[12].
Многодолевые почки, вероятно, появились в качестве адаптации к увеличению массы тела млекопитающих и соответствующей необходимости в увеличении количества нефронов в почках[13]. Дальнейшим адаптационным механизмом является увеличение размера почечных клубочков у крупных млекопитающих (и, соответственно, увеличения длины канальцев), как например, в случае слонов, у которых диаметр клубочка может быть в 2 раза больше, чем у косаток[81].
Появлению множественных почек, вероятно, способствовали как дальнейшее увеличение массы тела, так и особенности среды обитания[12][13]. Множественные почки, вероятно, позволяют увеличивать количество нефронов добавлением отдельных почечек без необходимости увеличения длины канальцев при увеличении размера органа[81].
Множественные почки
Множественные почки характерны в основном для морских млекопитающих. Считается, что они являются адаптацией как к большой массе, позволяя наращивать количество нефронов с увеличением количества почечек, так и к диете с большим количеством солёной воды, а также к необходимости в течение длительного времени погружаться под воду. Потребление излишней соли приводит к внутриклеточной дегидратации, в результате возникает необходимость в скорейшем выводе излишней соли из организма, чему в случае множественных почек способствует увеличение общей площади между корковым и мозговым веществом[12]. Необходимость погружаться на длительное время под воду требует сокращения потребления кислорода организмом[153], в то время как почки являются энергозатратным органом[154], поэтому во время погружений снижается скорость клубочковой фильтации[153]. Между же погружениями скорость клубочковой фильтрации у множественных почек является достаточно высокой[12].
Развитие почек
Стадии развития почек
У млекопитающих конечной почкой является метанефрическая почка, однако развитие почек происходит в 3 этапа с развитием 3 различных видов почек на этапе эмбрионального развития: пронефроса, мезонефроса и метанефроса[155][156]. Все 3 вида развиваются из промежуточной мезодермы последовательно в кранио-каудальном направлении (в направлении со стороны головы к хвостовой части тела)[156][157]. Сначала формируется пронефрос (предпочка), у млекопитающих он считается рудиментарным, то есть не функционирует[155]. Затем каудальнее пронефроса развивается мезонефрос (первичная почка), являющийся функционирующей почкой эмбриона[156][155]. Впоследствии у самок мезонефрос деградирует, а у самцов участвует в развитии половой системы. Третьей стадией является формирование в каудальной части зародыша метанефроса — постоянной почки[155].
Развитие метанефроса
Метанефрос развивается из зачатка мочеточника, выступающего на каудальной части первичного почечного протока[158][159], и метанефрогенной бластемы, являющейся частью промежуточной мезодермы, окружающей зачаток мочеточника[160][161]. Развитие метанефроса начинается с индуцирования мочеточниковым зачатком метанефрогенной бластемы[161][155], при этом по мере развития зачаток мочеточника и метанефрогенная бластема взаимно индуцируют друг друга[155]. Прорастая в мезодерму, зачаток мочеточника постепенно ветвится и преобразуется в древовидную структуру, которая в конечном итоге станет мочеточником, почечной лоханкой, большими и малыми чашечками, почечными сосочками и собирательными трубочками[162]. В то же время на концах прорастающих собирательных трубочек мезодерма дифференцируется в эпителиальные клетки, формирующие канальцы нефрона[163] (происходят процессы эпителизации и тубулогенеза)[164]. По мере развития нефронов развивается и кровоснабжение почки, при этом крупные сосуды берут начало ветвлением из спинной аорты[164].
У одних млекопитающих органогенез почек заканчивается до рождения, в то время как у других может продолжаться некоторое время и в послеродовой период[165] (например, у грызунов он заканчивается примерно через неделю после рождения)[166]. Когда формирование новых нефронов (нефрогенез) заканчивается, количество нефронов в почке становится окончательным[165].
Постнатальное созревание
После рождения и в постнатальный период почки функционально ещё незрелые, функциональное развитие почек у всех млекопитающих отстаёт от анатомического[167]. В постнатальный период масса канальцев недостаточно большая, поэтому возможности по реабсорбции жидкостей снижены по сравнению с почками взрослых млекопитающих[168]. В этот период происходит гипертрофия и гиперплазия канальцев, почки увеличиваются в размерах. Период, в течение которого формируются полностью функциональные почки, сильно варьируется между видами млекопитающих. У крыс почки достаточно быстро становятся полностью функциональными, в то время как у обезьян на это уходит 5 месяцев[167].
Повреждения и заболевания
Заболевания или нарушения, связанные с почками, могут быть врождёнными, наследственными, неинфекционными или инфекционными[29]. Между отдельными видами млекопитающих заболевания могут различаться. Могут встречаться заболевания, специфичные для одних видов и не встречающиеся у других, либо встречающиеся у одних видов реже, чем у других[32]. Например, хроническая прогрессирующая нефропатия характерна для мышей, крыс и голых землекопов[169], но в то же время у человека идентичного заболевания нет[170].
Врождённые и наследственные аномалии
Врождённые и наследственные аномалии почек млекопитающих встречаются достаточно редко, но могут оказывать значимое влияние на работу почек[171], в некоторых случаях могут приводить к смерти в раннем неонатальном периоде[172]. Среди аномалий развития почек встречаются гипоплазия и дисплазия почек (дисплазия может быть односторонней или двусторонней), агенезия (отсутствие) одной или обеих почек, поликистоз почек, простые почечные кисты, периренальные псевдокисты, удвоение или утроение почечных артерий, неправильное расположение почек[172] (эктопия почки)[167], подковообразная почка и нефробластома[172].
Неинфекционные заболевания
В число неинфекционных заболеваний непосредственно почек входят острое повреждение почки, хроническая болезнь почек[173], гломерулярные болезни[174] и заболевания, связанные с канальцами (почечный тубулярный ацидоз, синдром Фанкони и почечная глюкозурия)[175]. Новообразования в почках маленьких млекопитающих встречаются редко, но обычно не являются доброкачественными[176]. Новообразования и абсцессы являются редкими среди жвачных[177]. Обструктивные уропатии (препятствие оттоку мочи из одной или обеих почек) могут приводить к гидронефрозу с расширением почечной лоханки[178]. В почках также могут образовываться почечные камни (почечнокаменная болезнь)[179].
Причиной острого повреждения почек в большинстве случаев являются ишемические или токсические поражения[35]. Почки млекопитающих предрасположены к ишемическому повреждению, поскольку у млекопитающих отсутствует почечно-портальная система кровообращения, в результате чего вазоконстрикция сосудов в почечных клубочках может приводить к снижению уровня снабжения кровью почки в целом. К токсическому же повреждению почки предрасположены, поскольку в канальцах вместе с большинством отфильтрованных веществ может происходить реабсорбция и токсинов[35]. После острого повреждения почки способны восстановить свою работоспособность, однако оно способно перерасти в хроническое заболевание почек. При хроническом заболевании почек происходит потеря функциональности тканей почки, а само заболевание обычно является прогрессирующим[173].
Инфекционные заболевания
Инфекционные заболевания почек у маленьких млекопитающих обычно вызываются аэробными бактериями, среди которых кишечная палочка, стафилококки, энтерококки и стрептококки[180]. Грибковые и паразитарные инфекции почек у маленьких млекопитающих встречаются редко[180]. Пиелонефрит обычно развивается из-за бактерий, которые попадают в почки по восходящему пути из нижних частей мочевыделительной системы, реже через кровь[30]. У жвачных пиелонефрит чаще всего вызывается бактерией Corynebacterium renale и кишечной палочкой[31]. Питающиеся рыбой млекопитающие (например, норки или собаки), могут заражаться гигантской нематодой Dioctophyme renale[33]. Свиньи могут заражаться червём Stephanurus dentatus, который встречается во всём мире, но больше в тропиках и субтропиках[33][34]. Среди морских млекопитающих инфекции почек считаются редкими[181].
Старение
После созревания почек в них постепенно начинают происходить процессы старения, характерируемые изменениями в части анатомии, физиологии, функции и регенеративных возможностей. В течение жизни млекопитающих почечные клубочки подвергаются гломерулосклерозу, утолщается базальная мембрана, канальцы подвергаются атрофическим изменениям, а почечный интерстиций — фиброзу. Постепенно, но довольно медленно, снижается количество функционирующих нефронов. По части функции снижается скорость клубочковой фильтрации и способность концентрации мочи. Сами по себе возрастные изменения могут быть незаметными и могут не приводить в конечном итоге к почечной недостаточности или развитию заболевания, но являются фактором риска в случае возникновения заболевания почек или мочевыводящей системы[42].
Регенерация и способности к восстановлению
В отличие от более примитивных позвоночных, таких как рыбы, у млекопитающих нефрогенез заканчивается до или через некоторое время после рождения[38], когда заканчивается конденсированная мезенхима метанефротической бластемы, из которой новые нефроны образуются[182]. В результате у взрослых особей новые нефроны образовываться не могут[38]. Как следствие, после перенесённых повреждений почки взрослых млекопитающих не могут регенерировать путём образования новых нефронов[36]. Однако существуют другие компенсаторные и регенеративные механизмы восстановления функции почек[39].
Компенсаторные возможности
В случае односторонней нефрэктомии нагрузка на оставшуюся почку увеличивается, увеличивается скорость фильтрации и реабсорбции, происходят изменения в самих нефронах. Почечный клубочек может увеличиться в диаметре в два или три раза. Подобные компенсаторные изменения схожи с изменениями в нефронах, которые происходят после рождения по мере роста почки[183]. Резекция тканей почки также не вызывает процессов её регенерации[184], однако при повреждениях почек, в результате которых количество нефронов значительно сокращается, могут происходить компенсаторные изменения[185].
Регенерация нефрона
В рамках отдельно взятого нефрона регенеративные способности различаются между его частями[186]. При острых токсических и ишемических повреждениях канальцы способны регенерировать для восстановления функциональности нефрона[183]. В частности, способностью к регенерации обладает проксимальная часть нефрона[186], через которую всасывается до двух третей первичной мочи[187]. Именно эта части нефрона у млекопитающих наиболее подвержена риску ишемических или токсических повреждений[187]. Помимо этого, постоянное восстановление нефронов происходит в ходе нормальной физиологической деятельности из-за отслоения клеток эпителия канальцев[188]. Почечное тельце имеет сложную структуру, и его возможности восстановления после повреждения ограничены[189]. Мезангиальные (межсосудистые) и эндотелиальные клетки после повреждений способны пролиферировать и восстанавливать свою популяцию. Подоциты же в нормальных условиях не восстанавливаются[190].
Заживление тканей при повреждениях
В случае небольших повреждений канальцев нефрона потерянные клетки заменяются новыми, и эпителий регенерирует, восстанавливая свою структуру и функцию. При средних или тяжёлых повреждениях с большой потерей клеток шансы на регенерацию эпителия канальцев снижаются[37]. В таких случаях не происходит регенеративное восстановление тканей, и в ответ на повреждения возникают воспалительный ответ, и развивается фиброз тканей[37], являющиеся следующей линией защиты организма[191], которая в ходе эволюции млекопитающих должна была снижать возможное кровотечение и противодействовать возможной инфекции[41]. Подобная реакция характерна для острого повреждения почек[41], после которой почка способна восстановить свою работоспособность[192]. Фиброз является результатом неудачного заживления тканей почки и ассоциируется с нарушением работы почек[193], однако существует мнение, что фиброз помогает поддерживать выживание неповреждённых и частично повреждённых нефронов[194]. Хронические повреждения почек сопровождаются фиброзом, рубцеванием и потерей функциональности тканей[40], что характерно для хронической болезни почек[41].
Примечания
- ↑ 1 2 Abdalla, 2020, Abstract, p. 1.
- ↑ Withers, Cooper, Maloney et al., 2016, 1.2.8 Excretion, p. 25.
- ↑ 1 2 Keogh, Kilroy, Bhattacharjee, 2020, 7.3. Mammals, p. 8.
- ↑ 1 2 3 4 Dellmann's Textbook of Veterinary Histology : [англ.] / Ed.: Jo Ann Eurell, Brian L. Frappier. — 6th Edition. — Blackwell Publishing[d], 2006, July. — P. 566. — ISBN 978-0-7817-4148-4. — WD Q117031679.
- ↑ 1 2 3 4 Withers, Cooper, Maloney et al., 2016, 3.6.3 The Kidney, p. 250.
- ↑ The Unique Penile Morphology of the Short-Beaked Echidna, Tachyglossus aculeatus : [англ.] : [арх. 9 марта 2023] / Jane C. Fenelon[d], M. Caleb, G. Shaw[d] [et al.] // Sexual Development[d]. — 2021, 19 April. — Vol. 15, iss. 4. — P. 262—271. — ISSN 1661-5425, 1661-5433. — doi:10.1159/000515145. — WD Q117034134.
- ↑ 1 2 Fenton, Knepper, 2007, Abstract, p. 679.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72-73.
- ↑ 1 2 3 4 5 Breshears, Confer, 2017, Structure, p. 617.
- ↑ 1 2 3 4 5 Ortiz, 2001, Kidney structure, p. 1832.
- ↑ 1 2 Kriz, Kaissling, 2012, Renal vasculature, p. 595.
- ↑ 1 2 3 4 5 Zhou, Rong, Guo et al., 2023, Introduction, p. 2.
- ↑ 1 2 3 4 Zhou, Rong, Guo et al., 2023, The Evolution of Renal Structures Was Driven by Body Size and Habitats in Mammals, p. 6.
- ↑ 1 2 Davidson, 2009, Figure 1. Structure of the mammalian kidney.
- ↑ Dantzler, 2016.
- ↑ Casotti, Lindberg, Braun, 2000, p. R1723.
- ↑ Casotti, Lindberg, Braun, 2000, с. R1722-R1723.
- ↑ Little, McMahon, 2012, Summary, p. 1.
- ↑ Little, McMahon, 2012, An Overview of Cell Players and Cellular Processes in Metanephric Kidney Development, p. 2.
- ↑ Identification of molecular compartments and genetic circuitry in the developing mammalian kidney : [англ.] : [арх. 15 августа 2022] / Jing Yu, M. Todd Valerius, Mary Duah [et al.] // Development: the journal of the Society for International Development[d]. — 2012, 1 May. — Vol. 139, iss. 10. — P. 1863—1873. — ISSN 0950-1991, 1477-9129, 0212-2448, 1011-6370, 1461-7072. — doi:10.1242/dev.074005. — PMID 22510988. — WD Q30419294.
- ↑ 1 2 Bobulescu IA. Na+/H+ Exchangers in Renal Regulation of Acid-Base Balance : [англ.] : [рукопись] / Bobulescu IA, Moe OW // Seminars in nephrology[d]. — 2006, September. — Vol. 26, iss. 5. — P. 334—344. — ISSN 0270-9295, 1558-4488. — doi:10.1016/j.semnephrol.2006.07.001. — PMID 17071327. — WD Q28972309.
- ↑ 1 2 3 4 5 Stanniocalcin 1 effects on the renal gluconeogenesis pathway in rat and fish : [англ.] / Vanessa Schein[d], Luiz C Kucharski, Pedro M. Guerreiro[d] [et al.] // Molecular and Cellular Endocrinology[d]. — 2015, 15 July. — Vol. 414. — P. 1—8. — ISSN 0303-7207, 1872-8057. — doi:10.1016/j.mce.2015.07.010. — PMID 26187698. — WD Q57012122.
- ↑ Mammalogy : Adaptation, Diversity, Ecology : [англ.] / George A. Feldhamer[d], L. Drickamer[d], S. Vessey[d] [et al.]. — 4th Edition. — Baltimore : JHU Press, 2015. — P. 198. — ISBN 978-1-4214-1588-8. — WD Q117041834.
- ↑ Maria L. S. Sequeira Lopez. The renin phenotype: roles and regulation in the kidney : [англ.] : [рукопись] / Maria L. S. Sequeira Lopez, R. Ariel Gomez // Current Opinion in Nephrology and Hypertension[d]. — 2010, 1 July. — Vol. 19, iss. 4. — P. 366—371. — ISSN 1062-4821, 1473-6543, 1080-8221. — doi:10.1097/mnh.0b013e32833aff32. — PMID 20502328. — WD Q30431545.
- ↑ Sukanya Suresh. The Many Facets of Erythropoietin Physiologic and Metabolic Response : [англ.] : [арх. 8 мая 2022] / Sukanya Suresh, Praveen Kumar Rajvanshi[d], Constance T. Noguchi // Frontiers in Physiology[d]. — 2019, 1 January. — Vol. 10. — P. 1534. — ISSN 1664-042X. — doi:10.3389/fphys.2019.01534. — PMID 32038269. — WD Q89620015.
- ↑ 1 2 Bikle D. D. Vitamin D: an ancient hormone : [англ.] : [арх. 14 июля 2022] // Experimental Dermatology[d]. — 2011, 1 January. — Vol. 20, iss. 1. — P. 7—13. — ISSN 0906-6705, 1600-0625. — doi:10.1111/j.1600-0625.2010.01202.x. — PMID 21197695. — WD Q33783519.
- ↑ Osmotic and Ionic Regulation : Cells and Animals : [англ.] / Ed.: D. H. Evans. — CRC Press, 2008, 18 November. — P. 506. — ISBN 978-0-8493-8030-3. — WD Q117043359.
- ↑ Óscar Cortadellas Rodríguez. 3D Nephrology in Small Animals : [англ.] / Óscar Cortadellas Rodríguez, María Luisa Suárez Rey; illus.: Jacob Gragera Artal; transl.: Owen Howard. — Grupo Asís Biomedia S.L., 2018, February. — P. 5. — ISBN 978-84-17225-34-6. — WD Q117043609.
- ↑ 1 2 Urinary System : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 21 сентября 2023.
- ↑ 1 2 Pyelonephritis in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ 1 2 Giant hydronephrosis and secondary pyelonephritis induced by Salmonella dublin in a Holstein calf : [англ.] / T Taghipur Bazargani, A Khodakaram-Tafti, I Ashrafi, A M Abbassi // Iranian Journal of Veterinary Research[d]. — 2015, 1 January. — Vol. 16, iss. 1. — P. 114—116. — ISSN 1728-1997. — PMID 27175163. — WD Q38959395.
- ↑ 1 2 International Review of Experimental Pathology : [англ.]. Vol. 30. Kidney Disease / Ed.: G. W. Richter, Kim Solez[d]. — Academic Press, 1988. — P. 231—232. — ISSN 0074-7718. — ISBN 0-12-364930-7. — WD Q122870348.
- ↑ 1 2 3 Encyclopedia of Parasitology : [англ.] / Ed.: H. Mehlhorn[d]. — 3rd Edition. — Springer, 2007, 28 November. — P. 1532. — ISBN 978-3-540-48996-2, 978-3-540-48997-9, 978-3-540-48994-8. — doi:10.1007/978-3-540-48996-2. — WD Q122851992.
- ↑ 1 2 Swine Kidney Worm Infection : [англ.] : [арх. 4 июня 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ 1 2 3 Katja Berger. Mechanisms of epithelial repair and regeneration after acute kidney injury : [англ.] / Katja Berger, Marcus J. Moeller // Seminars in nephrology[d]. — 2014, 13 June. — Vol. 34, iss. 4. — P. 394—403. — ISSN 0270-9295, 1558-4488. — doi:10.1016/j.semnephrol.2014.06.006. — PMID 25217268. — WD Q38248788.
- ↑ 1 2 Little, McMahon, 2012, 7 Reassessing Renal Disease, Repair, and Regeneration Using Developmental Biology, p. 12.
- ↑ 1 2 3 Kumar, 2018, Figure 1 Schematic illustration highlighting patchy regenerative/reparative processes after mammalian acute kidney injury, p. 28.
- ↑ 1 2 3 Davidson, 2011, Introduction, p. 1435.
- ↑ 1 2 Davidson, 2011, Postnatal regenerative response of the mammalian kidney, p. 1437-1439.
- ↑ 1 2 Haller H. Chapter 34 — Kidney : [англ.] / H. Haller, S. Sorrentino // Regenerative Medicine[d] : From Protocol to Patient / Ed.: G. Steinhoff[d]. — Springer, 2011. — P. 811. — ISBN 978-90-481-9075-1, 978-90-481-9074-4. — WD Q118139734.
- ↑ 1 2 3 4 5 6 Chevalier Robert L. Evolutionary Nephrology : [англ.] // KI reports[d]. — 2017, 31 January. — Vol. 2, iss. 3. — P. 302—317. — ISSN 2468-0249. — doi:10.1016/j.ekir.2017.01.012. — PMID 28845468. — WD Q43573882.
- ↑ 1 2 Breshears, Confer, 2017, Aging of the Kidney, p. 637.
- ↑ Imaging the Renal Microcirculation in Cell Therapy : [англ.] : [арх. 10 марта 2023] / Katerina Apelt, Roel Bijkerk[d], Franck Lebrin[d], Ton J. Rabelink // Cells[d]. — 2021, 2 May. — Vol. 10, iss. 5. — ISSN 2073-4409. — doi:10.3390/cells10051087. — PMID 34063200. — WD Q117050923.
- ↑ Lauralee Sherwood. Animal Physiology : From Genes to Organisms : [англ.] / Lauralee Sherwood, Hillar Klandorf[d], Paul H. Yancey. — 2nd Edition. — Cengage Group[d], 2012. — P. 569. — ISBN 978-0-8400-6865-1. — WD Q117048829.
- ↑ Ecological and Environmental Physiology of Mammals : [англ.] / P. C. Withers, C. E. Cooper, S. K. Maloney [et al.]. — Oxford University Press, 2016. — P. 250. — ISBN 978-0-19-964271-7, 978-0-19-964272-4. — WD Q115609411.
- ↑ Christopher Thigpen. Comparative morphology and allometry of select extant cryptodiran turtle kidneys : [англ.] : [арх. 22 мая 2022] / Christopher Thigpen, Logan Best, Troy Camarata // Zoomorphology. — 2019, 28 September. — Vol. 139. — P. 111–121. — ISSN 0720-213X, 1432-234X. — doi:10.1007/s00435-019-00463-3. — WD Q117048961.
- ↑ 1 2 3 Donald W. Linzey[d]. Vertebrate Biology : [англ.]. — 2nd Edition. — 2012, 13 February. — P. 319. — ISBN 978-1-4214-0040-2. — WD Q117048995.
- ↑ C. De Martino. Microscopic structure of the kidney : [англ.] / C. De Martino, D. J. Allen, L. Accinni // Basic, Clinical, and Surgical Nephrology[d] / Ed.: L. J. A. Didio, P. M. Motta. — Boston : Martinus Nijhoff Publishers[d], 1985. — P. 53–82. — ISBN 978-1-4612-9616-4, 978-1-4613-2575-8. — WD Q117050154.
- ↑ 1 2 Davidson, 2009, Figure 1 Structure of the mammalian kidney.
- ↑ Moffat D. B. The Mammalian Kidney : [англ.]. — Cambridge University Press, 1975. — P. 16—18. — (Biological Structure and Function Books; 5). — ISBN 0-521-20599-9. — WD Q117051109.
- ↑ 1 2 3 4 The Editors of Encyclopaedia. Renal pyramid : [англ.] : [арх. 2 мая 2022] // Encyclopædia Britannica : online encyclopedia. — Дата обновления: 20 июня 2018. — Дата обращения: 2 мая 2022.
- ↑ James Arthur Ramsay. Excretion : Mammals : [англ.] / James Arthur Ramsay, Fenton Crosland Kelley // Encyclopædia Britannica : online encyclopedia. — 2020, 2 April. — Дата обращения: 4 июня 2022.
- ↑ Kriz, Kaissling, 2012, Figure 20.9 Schematic of nephrons and collecting duct, p. 602.
- ↑ Anatomy of the Kidney & Ureter : [англ.] // SEER Training. — U. S. National Cancer Institute. — Дата обращения: 29 июля 2022.
- ↑ Dyce Keith M. Textbook of Veterinary Anatomy : [англ.] / Keith M. Dyce, Wolfgang O. Sack, C. J. G. Wensing. — Fourth Edition. — Saunders[d], 2010. — P. 177. — ISBN 978-1-4160-6607-1. — WD Q117066071.
- ↑ Davidson, 2009, Figure 1. Structure of the mammalian kidney, p. 2.
- ↑ Zhuo Jia L. Proximal nephron : [англ.] : [рукопись] / Jia L. Zhuo, Xiao C. Li // Comprehensive Physiology[d]. — 2013, July. — Vol. 3, iss. 3. — P. 1079—123. — ISSN 2040-4603. — doi:10.1002/cphy.c110061. — PMID 23897681. — WD Q28388052.
- ↑ Grant Maxie, 2015, Anatomy, p. 379.
- ↑ 1 2 Sands, Layton, 2012, Kidney Structure, с. 1464.
- ↑ Sands, Verlander, 2004, Figure 1.1 A long-looped and short-looped nephron together with the collecting system, p. 4-5.
- ↑ Kriz, Kaissling, 2012, Nephrons and Collecting Duct System, p. 600.
- ↑ 1 2 3 Kriz, Kaissling, 2012, Kidney Types and Renal Pelvis, p. 595.
- ↑ 1 2 Sands, Verlander, 2004, Cortex, p. 6.
- ↑ 1 2 Silva's Diagnostic Renal Pathology : [англ.] / Ed.: Xin J. Zhou [et al.]. — Cambridge University Press, 2017, 2 March. — P. 19. — WD Q117066851.
- ↑ Grant Maxie, 2015, Anatomy, p. 378.
- ↑ Davidson, 2009, Overview of kidney structure and embryonic development.
- ↑ 1 2 The Kidney : Morphology, Biochemistry, Physiology : [англ.]. Vol. 1 / Ed.: C. Rouiller, A. F. Muller. — Academic Press, 1969. — P. 357. — ISBN 978-1-4832-7174-3. — WD Q117068124.
- ↑ 1 2 Sands, Verlander, 2004, Outer Medulla, p. 8.
- ↑ Kriz W. Structure and Function of the Renal Medulla : [англ.] // Paediatric nephrology[d]. — Springer Verlag, 1984. — P. 3–10. — ISBN 978-3-540-13598-2, 978-3-642-69863-7. — doi:10.1007/978-3-642-69863-7_1. — WD Q117072065.
- ↑ 1 2 3 Casotti, Lindberg, Braun, 2000, p. R1722.
- ↑ Dantzler, 2016, 2.2.6 Mammals, p. 20.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72—73.
- ↑ ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 73.
- ↑ Abdalla, 2020, 3. Results and discussion, p. 3.
- ↑ 1 2 3 ВОЗ, 1994, 3.4 Видовые, линейные и половые различия в строении и функции почек, с. 72.
- ↑ Proliferative and nonproliferative lesions of the rat and mouse urinary system : [англ.] : [арх. 27 декабря 2022] / Kendall S. Frazier, John Curtis Seely, Gordon C. Hard [et al.] // Toxicologic Pathology[d]. — 2012, 1 June. — Vol. 40, iss. 4 Suppl. — P. 14S—86S. — ISSN 0192-6233, 1533-1601. — doi:10.1177/0192623312438736. — PMID 22637735. — WD Q48636042.
- ↑ Richard Nickel. The Viscera of the Domestic Mammals = Lehrbuch der Anatomie der Haustiere : [англ.] : Transl. from German / Richard Nickel, August Schummer, Eugen Seiferle. — Second revised edition. — Berlin, 1979. — P. 286. — ISBN 978-1-4757-6816-9. — doi:10.1007/978-1-4757-6814-5. — WD Q117074872.
- ↑ Dantzler, 2016, 2.2.6 Mammals, p. 19—20.
- ↑ Sur R. L., Meegan J. M., Smith C. R., Schmitt T., L'Esperance J., Hendrikson D., Woo J. R. Surgical Management of Nephrolithiasis in the Bottlenose Dolphin: Collaborations Between the Urologist and Veterinarian. (англ.) // Journal of endourology case reports — 2018. — Vol. 4, Iss. 1. — P. 62—65. — ISSN 2379-9889 — doi:10.1089/CREN.2017.0143 — PMID:29756043
- ↑ Keogh, Kilroy, Bhattacharjee, 2020, 7.3.1. Mammalian kidneys: overall morphology, p. 8.
- ↑ 1 2 3 Little Melissa H. Returning to kidney development to deliver synthetic kidneys : [англ.] : [арх. 12 марта 2023] // Developmental Biology[d]. — 2020, 14 December. — ISSN 0012-1606, 1095-564X. — doi:10.1016/j.ydbio.2020.12.009. — PMID 33333068. — WD Q104492546.
- ↑ Russell, Hong, Windsor et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Renal Interstitium, p. 6.
- ↑ Kriz, Kaissling, 2012, Interstitium : Definition, p. 602.
- ↑ 1 2 Michael Zeisberg. Physiology of the Renal Interstitium : [англ.] / Michael Zeisberg, Raghu Kalluri // Clinical Journal of the American Society of Nephrology[d]. — 2015, 26 March. — Vol. 10, iss. 10. — P. 1831—1840. — ISSN 1555-9041, 1555-905X. — doi:10.2215/cjn.00640114. — PMID 25813241. — WD Q36123584.
- ↑ 1 2 Russell, Hong, Windsor et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Morphology of Renal Lymph Vessels, p. 6.
- ↑ Kriz, Kaissling, 2012, Interstitial Fibroblasts, p. 602.
- ↑ Breshears, Confer, 2017, Interstitium, p. 622.
- ↑ Defining the variety of cell types in developing and adult human kidneys by single-cell RNA sequencing : [англ.] : [арх. 13 марта 2023] / A. Schumacher, M. B. Rookmaaker, J. A. Joles [et al.] // Npj regenerative medicine[d]. — 2021, 11 August. — Vol. 6. — Article 45. — ISSN 2057-3995. — doi:10.1038/s41536-021-00156-w. — WD Q117085458.
- ↑ C Schell. Glomerular development--shaping the multi-cellular filtration unit : [англ.] / C Schell, N Wanner, T B Huber // Seminars in Cell & Developmental Biology[d]. — 2014, 18 August. — Vol. 36. — P. 39—49. — ISSN 1084-9521, 1096-3634. — doi:10.1016/j.semcdb.2014.07.016. — PMID 25153928. — WD Q34434949.
- ↑ 1 2 Renal-Tubule Epithelial Cell Nomenclature for Single-Cell RNA-Sequencing Studies : [англ.] : [арх. 13 марта 2023] / Lihe Chen, Jevin Z Clark, J. Nelson[d] [et al.] // Journal of the American Society of Nephrology[d]. — 2019, 28 June. — Vol. 30, iss. 8. — P. 1358—1364. — ISSN 1046-6673, 1533-3450. — doi:10.1681/asn.2019040415. — PMID 31253652. — WD Q93115184.
- ↑ Jae Wook Lee. Deep Sequencing in Microdissected Renal Tubules Identifies Nephron Segment-Specific Transcriptomes : [англ.] : [арх. 13 марта 2023] / Jae Wook Lee, Chung-Lin Chou, Mark A Knepper[d] // Journal of the American Society of Nephrology[d]. — 2015, 27 March. — Vol. 26, iss. 11. — P. 2669—2677. — ISSN 1046-6673, 1533-3450. — doi:10.1681/asn.2014111067. — PMID 25817355. — WD Q35589079.
- ↑ Balzer, Rohacs, Susztak, 2022, Introduction, p. 1.
- ↑ 1 2 3 4 Grant Maxie, 2015, Vascular supply, p. 379.
- ↑ Kriz, Kaissling, 2012, Renal vasculature, p. 596.
- ↑ Holz Peter H. The Reptilian Renal Portal System — A ReviewP1476? : [англ.] // Bulletin of the Association of Reptilian and Amphibian Veterinarians[d]. — 1999, 1 January. — Vol. 9, iss. 1. — P. 4–14. — ISSN 1076-3139. — doi:10.5818/1076-3139.9.1.4. — WD Q117088499.
- ↑ Kotpal R. L. Modern Text Book of Zoology : Vertebrates : [англ.]. Vol. 2. — Rastogi Publications, 2010. — P. 782. — ISBN 978-81-7133-891-7. — WD Q117088647.
- ↑ Keogh, Kilroy, Bhattacharjee, 2020, 6. Renal portal system, p. 6.
- ↑ Schmidt-Nielsen K. Animal Physiology : [англ.]. — Cambridge University Press, 1997, 9 June. — P. 371. — ISBN 0-521-57098-0. — WD Q117089453.
- ↑ Biology of Marine Mammals : [англ.] / Ed.: John E. Reynolds. — Smithsonian Institution, 2013. — P. 299. — ISBN 978-1-58834-420-5. — WD Q117089734.
- ↑ David A D Munro. Cycles of vascular plexus formation within the nephrogenic zone of the developing mouse kidney : [англ.] / David A D Munro, P. Hohenstein[d], J. A. Davies[d] // Scientific Reports[d]. — 2017, 12 June. — Vol. 7, iss. 1. — P. 3273. — ISSN 2045-2322. — doi:10.1038/s41598-017-03808-4. — PMID 28607473. — WD Q42177011.
- ↑ Russell, Hong, Windsor et al., 2019, Introduction, p. 1.
- ↑ Renal lymphatic vessel dynamics : [англ.] : [арх. 13 марта 2023] / Elaine L. Shelton, Hai-Chun Yang, Jianyong Zhong [et al.] // American journal of physiology[d] : Renal Physiology. — 2020, 26 October. — ISSN 1931-857X, 1522-1466, 0363-6127. — doi:10.1152/ajprenal.00322.2020. — PMID 33103446. — WD Q100995658.
- ↑ Russell, Hong, Windsor et al., 2019, Renal Lymphatic Physiology under Normal Conditions : Formation of Renal Lymph, p. 7.
- ↑ 1 2 Harald Seeger. The role of lymphatics in renal inflammation : [англ.] : [арх. 13 марта 2023] / Harald Seeger, Marco Bonani, Stephan Segerer[d] // Nephrology Dialysis Transplantation[d]. — 2012, 23 May. — Vol. 27, iss. 7. — P. 2634—2641. — ISSN 0931-0509, 1460-2385. — doi:10.1093/ndt/gfs140. — PMID 22622451. — WD Q84203623.
- ↑ Russell, Hong, Windsor et al., 2019, Anatomy of Renal Lymphatics : Renal Vascular Anatomy, p. 2.
- ↑ 1 2 3 4 Russell, Hong, Windsor et al., 2019, Comparative Renal Lymphatic Anatomy : Mammalian Renal Lymphatic Anatomy, p. 3.
- ↑ Russell, Hong, Windsor et al., 2019, Renal Lymphatic Physiology under Normal Conditions : Interstitial Fluid and Protein Drainage in the Medulla, p. 9.
- ↑ 1 2 Russell, Hong, Windsor et al., 2019, Detailed Features of Human and Mammalian Renal Lymphatic Anatomy : Medullary Lymphatics, p. 5.
- ↑ Russell, Hong, Windsor et al., 2019, Table 1. Comparison of renal lymphatic anatomy between species, p. 5.
- ↑ 1 2 3 4 Kopp, 2018, 2.2 Intrarenal Distribution of Efferent Renal Sympathetic Nerves, p. 6.
- ↑ Почки : [арх. 5 октября 2022] // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Yasuna Nakamura. Neuroimmune Communication in the Kidney : [англ.] / Yasuna Nakamura, Tsuyoshi Inoue // JMA journal[d]. — 2020, 8 July. — Vol. 3, iss. 3. — P. 164—174. — ISSN 2433-328X, 2433-3298. — doi:10.31662/jmaj.2020-0024. — PMID 33150250. — WD Q101322955.
- ↑ Kopp, 2011, Abstract.
- ↑ Kriz, Kaissling, 2012, Nerves, p. 610.
- ↑ Kopp Ulla C. 7.1. Kidney : [англ.] // Neural Control of Renal Function / Ulla C. Kopp. — San Rafael : Morgan & Claypool Life Sciences, 2011, 20 August. — WD Q121112788.
- ↑ Kopp Ulla C. 2.1. Neural Pathways : [англ.] // Neural Control of Renal Function / Ulla C. Kopp. — San Rafael : Morgan & Claypool Life Sciences, 2011, 20 August. — WD Q121112788.
- ↑ Kopp, 2018, Introduction, p. 1.
- ↑ Kopp, 2011, 8.1. Activation of Afferent Renal Sensory Nerves by Physiological Stimuli.
- ↑ 1 2 Knepper MA. Pathways of urea transport in the mammalian kidney : [англ.] / Knepper MA, Roch-Ramel F // Kidney International[d]. — 1987, 1 February. — Vol. 31, iss. 2. — P. 629—633. — ISSN 0085-2538, 1523-1755. — doi:10.1038/ki.1987.44. — PMID 3550233. — WD Q39762062.
- ↑ James Arthur Ramsay. Excretion : General features of excretory structures and functions : [англ.] / James Arthur Ramsay, Fenton Crosland Kelley // Encyclopædia Britannica : online encyclopedia. — Дата обновления: 2 апреля 2020. — Дата обращения: 4 июня 2022.
- ↑ Fenton R.[d] Urea and renal function in the 21st century: insights from knockout mice : [англ.] : [арх. 9 марта 2023] / R. Fenton, Mark A Knepper[d] // Journal of the American Society of Nephrology[d]. — 2007, March. — Vol. 18, iss. 3. — P. 679—88. — ISSN 1046-6673, 1533-3450. — doi:10.1681/asn.2006101108. — PMID 17251384. — WD Q28284934.
- ↑ Bradley, 2009, 8.4 Terrestrial vertebrates, p. 121.
- ↑ 1 2 3 4 5 Sands, Layton, 2009, Introduction.
- ↑ Bernard C Rossier. Osmoregulation during Long-Term Fasting in Lungfish and Elephant Seal: Old and New Lessons for the Nephrologist : [англ.] : [арх. 22 сентября 2022] // The Nephron Journals[d]. — 2016, 23 February. — Vol. 134, iss. 1. — P. 5—9. — ISSN 1660-8151, 2235-3186. — doi:10.1159/000444307. — PMID 26901864. — WD Q57865766.
- ↑ Mark A Knepper[d]. Molecular physiology of water balance : [англ.] / Mark A Knepper, Tae-Hwan Kwon, Soren Nielsen // The New England Journal of Medicine. — 2015, 1 April. — Vol. 372, iss. 14. — P. 1349—1358. — ISSN 0028-4793, 1533-4406. — doi:10.1056/nejmra1404726. — PMID 25830425. — WD Q38399100.
- ↑ 1 2 Schulte, Kunter, Moeller, 2014, Adapting to living on dry land: the water-retaining kidney was invented twice, p. 718.
- ↑ Lote C.[d] The loop of Henle, distal tubule and collecting duct : [англ.] / C. Lote, Christopher J. Lote. — Springer New York[d], 2012, 22 June. — P. 70–85. — ISBN 978-1-4614-3785-7, 978-1-4614-3784-0. — doi:10.1007/978-94-011-4086-7_6. — WD Q117104227.
- ↑ "Avian-type" renal medullary tubule organization causes immaturity of urine-concentrating ability in neonates : [англ.] : [арх. 14 марта 2022] / Liu W, Morimoto T, Kondo Y [et al.] // Kidney International[d]. — 2001, 1 August. — Vol. 60, iss. 2. — P. 680—693. — ISSN 0085-2538, 1523-1755. — doi:10.1046/j.1523-1755.2001.060002680.x. — PMID 11473651. — WD Q43688352.
- ↑ Abdalla, 2020, 1. Introduction, p. 1—2.
- ↑ Maria L. S. Sequeira Lopez. The renin phenotype: roles and regulation in the kidney : [англ.] : [рукопись] / Maria L. S. Sequeira Lopez, R. Ariel Gomez // Current Opinion in Nephrology and Hypertension[d]. — 2010, 1 July. — Vol. 19, iss. 4. — P. 366—371. — ISSN 1062-4821, 1473-6543, 1080-8221. — doi:10.1097/mnh.0b013e32833aff32. — PMID 20502328. — WD Q30431545.
- ↑ Sukanya Suresh. The Many Facets of Erythropoietin Physiologic and Metabolic Response : [англ.] : [арх. 8 мая 2022] / Sukanya Suresh, Praveen Kumar Rajvanshi[d], Constance T. Noguchi // Frontiers in Physiology[d]. — 2019, 1 January. — Vol. 10. — P. 1534. — ISSN 1664-042X. — doi:10.3389/fphys.2019.01534. — PMID 32038269. — WD Q89620015.
- ↑ Bradley, 2009, 11.5 The mammalian kidney, p. 164.
- ↑ Emergence and evolution of the renin-angiotensin-aldosterone system : [англ.] / David Fournier, Friedrich C Luft[d], Michael Bader[d] [et al.] // Journal of Molecular Medicine[d]. — Vol. 90, iss. 5. — P. 495—508. — ISSN 0946-2716, 1432-1440. — doi:10.1007/s00109-012-0894-z. — PMID 22527880. — WD Q28729911.
- ↑ 1 2 Sequeira-Lopez Maria Luisa S. Renin Cells, the Kidney, and Hypertension : [англ.] : [арх. 26 сентября 2022] / Maria Luisa S. Sequeira-Lopez, R. Ariel Gomez // Circulation Research[d] : scientific journal. — 2021, 2 April. — Vol. 128, iss. 7. — P. 887–907. — ISSN 0009-7330, 1524-4571. — doi:10.1161/circresaha.121.318064. — PMID 33793334.
- ↑ Ionic Regulation in Animals : A Tribute to Professor W.T.W.Potts : [англ.] / Ed.: N. Hazon [et al.]. — Springer-Verlag, 2012, 6 December. — P. 153. — ISBN 978-3-642-64396-5, 978-3-642-60415-7. — doi:10.1007/978-3-642-60415-7. — WD Q117104121.
- ↑ Eladari, 2014, Introduction, p. 1623.
- ↑ Lauralee Sherwood. Animal Physiology : From Genes to Organisms : [англ.] / Lauralee Sherwood, Hillar Klandorf[d], Paul H. Yancey. — 2nd Edition. — Cengage Group[d], 2012. — P. 637. — ISBN 978-0-8400-6865-1. — WD Q117048829.
- ↑ 1 2 Membrane Transporter Diseases : [англ.] / Ed.: C. A. Wagner[d], Stefan Broer[d]. — Springer Science+Business Media, 2004, 31 March. — P. 66. — ISBN 978-1-4613-4761-3, 978-1-4419-9023-5. — doi:10.1007/978-1-4419-9023-5. — WD Q117190520.
- ↑ 1 2 3 4 James L. Lewis III. Acid-Base Regulation : [англ.] : [арх. 19 марта 2023] // MSD Manuals — Medical Professional Version. — 2021, July. — Дата обращения: 17 марта 2023.
- ↑ 1 2 3 Eladari, Hasler, Féraille, 2012, Bicarbonate Absorption, p. 84.
- ↑ 1 2 Eladari, 2014, Renal ammonia handling : Fig. 3, p. 1629.
- ↑ 1 2 Eladari, 2014, Renal ammonia handling, p. 1627.
- ↑ 1 2 Eladari, 2014, Renal ammonia handling, p. 1627-1628.
- ↑ Eladari, 2014, Renal ammonia handling : Fig.2, p. 1628.
- ↑ Klaus Urich[d]. Comparative Animal Biochemistry : [англ.] / Illus.: Charlotte Urich; transl.: P. J. King. — Springer Berlin Heidelberg[d], 2013, 17 April. — P. 534. — ISBN 978-3-642-08181-1, 978-3-662-06303-3. — doi:10.1007/978-3-662-06303-3. — WD Q123236759.
- ↑ 1 2 Leszek Szablewski[d]. Glucose Homeostasis and Insulin Resistance : [англ.]. — Bentham Science Publishers[d], 2011, 14 April. — P. 77—78. — ISBN 978-1-60805-189-2. — WD Q123237143.
- ↑ 1 2 Vize, Smith, 2004, p. 352.
- ↑ Vize, Smith, 2004, p. 351.
- ↑ 1 2 3 4 Convergent evolution of increased urine‐concentrating ability in desert mammals : [англ.] / Joana L. Rocha, José C. Brito, Rasmus Nielsen, Raquel Godinho // Mammal Review[d]. — 2021, 1 March. — Vol. 51, iss. 4. — P. 482—491. — ISSN 1365-2907, 0305-1838. — doi:10.1111/mam.12244. — WD Q112795614.
- ↑ Dantzler W.[d] Renal Adaptations of Desert Vertebrates : [англ.] // BioScience[d]. — 1982, February. — Vol. 32, iss. 2. — P. 108—113. — ISSN 0006-3568, 1525-3244. — doi:10.2307/1308563. — OCLC 610211421. — WD Q121096094.
- ↑ Abraham Allan Degen[d]. Ecophysiology of Small Desert Mammals : [англ.] / Ed.: J. Thompson. — Springer, 1997. — P. 118. — ISBN 978-3-642-64366-8, 978-3-642-60351-8. — doi:10.1007/978-3-642-60351-8. — WD Q122965291.
- ↑ Zhou, Rong, Guo et al., 2023, Introduction, p. 1.
- ↑ 1 2 Ortiz, 2001, Apnea/simulated diving, p. 1838.
- ↑ Ying Chen. Modeling Glucose Metabolism in the Kidney : [англ.] : [рукопись] / Ying Chen, Brendan C Fry, Anita T Layton[d] // Bulletin of Mathematical Biology[d]. — 2016, 1 July. — Vol. 78, iss. 6. — P. 1318—1336. — ISSN 0092-8240, 1522-9602. — doi:10.1007/s11538-016-0188-7. — PMID 27371260. — WD Q33683963.
- ↑ 1 2 3 4 5 6 Bush, Sakurai, Nigam, 2012, Overview, pp. 859.
- ↑ 1 2 3 Davies J. A.[d] Kidney Development : [англ.] // ELS[d]. — 2013, 19 September. — ISBN 978-0-470-01590-2. — doi:10.1002/9780470015902.a0001152.pub3. — WD Q117156103.
- ↑ Davidson, 2009, 1. Overview of kidney structure and embryonic development.
- ↑ Morphometric index of the developing murine kidney : [англ.] / Cristina Cebrián, Karolina Borodo, Nikki Charles, Doris A. Herzlinger // Developmental Dynamics[d]. — 2004, 1 November. — Vol. 231, iss. 3. — P. 601—608. — ISSN 1058-8388, 1097-0177. — doi:10.1002/dvdy.20143. — PMID 15376282. — WD Q50792365.
- ↑ Chambers J.[d] Advances in understanding vertebrate nephrogenesis : [англ.] / J. Chambers, Rebecca A Wingert[d] // Tissue Barriers[d]. — 2020, 22 October. — P. 1832844. — ISSN 2168-8362, 2168-8370. — doi:10.1080/21688370.2020.1832844. — PMID 33092489. — WD Q100943416.
- ↑ Bush, Sakurai, Nigam, 2012, Overview, pp. 859-860.
- ↑ 1 2 Kispert A. Wnt-4 is a mesenchymal signal for epithelial transformation of metanephric mesenchyme in the developing kidney : [англ.] / A. Kispert, S. Vainio[d], A. P. McMahon // Development: the journal of the Society for International Development[d]. — 1998, 1 November. — Vol. 125, iss. 21. — P. 4225—4234. — ISSN 0950-1991, 1477-9129, 0212-2448, 1011-6370, 1461-7072. — doi:10.1242/dev.125.21.4225. — PMID 9753677. — WD Q41006079.
- ↑ Bush, Sakurai, Nigam, 2012, Development of the Metanephros, p. 861-862.
- ↑ Bush, Sakurai, Nigam, 2012, Development of the Metanephros, p. 860.
- ↑ 1 2 Bush, Sakurai, Nigam, 2012, Development of the Metanephros, p. 861.
- ↑ 1 2 Bush, Sakurai, Nigam, 2012, Termination of the Kidney Development, p. 882.
- ↑ Abrahamson Dale R. Development of kidney glomerular endothelial cells and their role in basement membrane assembly : [англ.] // Organogenesis[d]. — 2009, 1 January. — Vol. 5, iss. 1. — P. 275—287. — ISSN 1547-6278, 1555-8592. — doi:10.4161/org.7577. — PMID 19568349. — WD Q42235704.
- ↑ 1 2 3 John Curtis Seely. A brief review of kidney development, maturation, developmental abnormalities, and drug toxicity: juvenile animal relevancy : [англ.] // Journal of Toxicologic Pathology[d]. — 2017, 11 February. — Vol. 30, iss. 2. — P. 125—133. — ISSN 0914-9198, 1881-915X. — doi:10.1293/tox.2017-0006. — PMID 28458450. — WD Q33607543.
- ↑ Kendall S. Frazier[d]. Species Differences in Renal Development and Associated Developmental Nephrotoxicity : [англ.] // Birth Defects Research[d]. — 2017, 2 August. — Vol. 109, iss. 16. — P. 1243—1256. — ISSN 2472-1727. — doi:10.1002/bdr2.1088. — PMID 28766875. — WD Q88659637.
- ↑ Pathology of Wildlife and Zoo Animals : [англ.] / Ed.: Karen A. Terio [et al.]. — Academic Press, 2018, 8 October. — P. 503. — ISBN 978-0-12-805306-5. — WD Q122849312.
- ↑ Hard Gordon C. A comparison of rat chronic progressive nephropathy with human renal disease-implications for human risk assessment : [англ.] / Gordon C. Hard, Kent J. Johnson, Samuel M. Cohen // Critical Reviews in Toxicology[d]. — 2009, 1 January. — Vol. 39, iss. 4. — P. 332—346. — ISSN 1040-8444, 1547-6898. — doi:10.1080/10408440802368642. — PMID 19514917. — WD Q37514291.
- ↑ Overview of Congenital and Inherited Anomalies of the Urinary System : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 23 сентября 2023.
- ↑ 1 2 3 Renal Anomalies : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 23 сентября 2023.
- ↑ 1 2 Renal Dysfunction in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Glomerular Disease in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Renal Tubular Defects in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Neoplasia of the Urinary System in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Large Animal Internal Medicine : [англ.] / Ed.: Bradford P. Smith. — Fifth Edition. — Elsevier, 2014, April. — P. 768. — ISBN 978-0-323-08839-8. — WD Q122886585.
- ↑ Obstructive Uropathy in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Urolithiasis in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ 1 2 Overview of Infectious Diseases of the Urinary System in Small Animals : [англ.] : [арх. 27 сентября 2023] // Merck Veterinary Manual. — Дата обращения: 24 сентября 2023.
- ↑ Pathobiology Of Marine Mammal Diseases : [англ.]. Vol. 1 / Ed.: Edwin B. Howard. — CRC Press, 2017, 13 December. — P. 30. — WD Q122880668.
- ↑ Davidson, 2011, Cessation of mammalian nephrogenesis, p. 1436.
- ↑ 1 2 Davidson, 2011, Postnatal regenerative response of the mammalian kidney, p. 1437.
- ↑ Ariela Benigni[d]. Kidney regeneration : [англ.] / Ariela Benigni, Marina Morigi[d], G. Remuzzi[d] // The Lancet. — 2010, 1 April. — Vol. 375, iss. 9722. — P. 1310—1317. — ISSN 0140-6736, 1474-547X. — doi:10.1016/s0140-6736(10)60237-1. — PMID 20382327. — WD Q37728655.
- ↑ Davidson, 2011, Conclusions and perspectives, p. 1441.
- ↑ 1 2 Yang, Liu, Fogo, 2014, What Is Kidney Regeneration?.
- ↑ 1 2 Nephron Repair in Mammals and Fish : [англ.] // Kidney Transplantation in the Regenerative Medicine Era[d] : Kidney Transplantation in the Regenerative Medicine Era / Ed.: David F. Williams [et al.]. — Academic Press, 2017, 8 June. — P. 997. — ISBN 978-0-12-801734-0. — WD Q118136559.
- ↑ Davidson, 2011, Postnatal regenerative response of the mammalian kidney, p. 1438.
- ↑ Yang, Liu, Fogo, 2014, Introduction.
- ↑ Yang, Liu, Fogo, 2014, Mechanisms of Kidney Regeneration.
- ↑ Qi Cao. Macrophages in kidney injury, inflammation, and fibrosis : [англ.] / Qi Cao, David C H Harris, Yiping Wang // Physiology[d]. — 2015, 1 May. — Vol. 30, iss. 3. — P. 183—194. — ISSN 1548-9213, 1548-9221, 0886-1714, 1522-161X. — doi:10.1152/physiol.00046.2014. — PMID 25933819. — WD Q38453872.
- ↑ Medaka : A Model for Organogenesis, Human Disease, and Evolution : [англ.] / Ed.: Kiyoshi Naruse[d] [et al.]. — Tokyo; NYC : Springer, 2011, 30 May. — P. 112. — ISBN 978-4-431-92690-0, 978-4-431-92691-7. — doi:10.1007/978-4-431-92691-7. — WD Q122851644.
- ↑ Nogueira, Pires, Oliveira, 2017, Impact of Renal Fibrosis on Human Health, p. 3.
- ↑ Nogueira, Pires, Oliveira, 2017, Renal Fibrosis: Aetiology and Pathophysiology, p. 2.
Литература
Книги
- Принципы и методы оценки нефротоксичности, связанной с воздействием химических веществ. = Principles and methods for the assessment of nephrotoxicity associated with exposure to chemicals : [арх. 11 сентября 2022] : Пер. с англ. — Женева : ВОЗ, 1994. — С. 72—73. — (Гигиенические критерии состояния окружающей среды; 119). — ISBN 5-225-01924-2. — WD Q115707521.
- Davidson Alan J. Mouse kidney development : [англ.] : [арх. 4 марта 2022] // StemBook. — 2009, 15 January. — doi:10.3824/stembook.1.34.1. — PMID 20614633. — WD Q95000300.
- Dantzler W.[d] Comparative Physiology of the Vertebrate Kidney : [англ.]. — Springer, 2016, 5 July. — 292 p. — ISBN 978-1-4939-3734-9. — WD Q115604361.
- Eladari D. Chapter 3 — Renal Ion-Translocating ATPases : [англ.] / D. Eladari, U. Hasler, E. Féraille // Seldin and Giebisch's The Kidney : Physiology and pathophysiology : in 2 vols. / Ed.: R. J. Alpern [et al.]. — Fifth edition. — Amsterdam : Academic Press, 2012, 31 December. — Vol. 1—2. — P. 84—85. — ISBN 978-0-12-381463-0, 978-0-12-381462-3. — WD Q114595502.
- Kriz W. Chapter 20 — Structural Organization of the Mammalian Kidney : [англ.] / Kriz W., Kaissling B. // Seldin and Giebisch's The Kidney : Physiology and pathophysiology : in 2 vols. / Ed.: R. J. Alpern [et al.]. — Fifth edition. — Amsterdam : Academic Press, 2012, 31 December. — Vol. 1—2. — P. 595—691. — ISBN 978-0-12-381463-0, 978-0-12-381462-3. — WD Q114595502.
- Sands J. M. Chapter 43 — Urine Concentrating Mechanism and Urea Transporters : [англ.] / J. M. Sands, H. E. Layton // Seldin and Giebisch's The Kidney : Physiology and pathophysiology : in 2 vols. / Ed.: R. J. Alpern [et al.]. — Fifth edition. — Amsterdam : Academic Press, 2012, 31 December. — Vol. 1—2. — 3290 p. — ISBN 978-0-12-381463-0, 978-0-12-381462-3. — WD Q114595502.
- Bush Kevin T. Chapter 25 — Molecular and Cellular Mechanisms of Kidney Development : [англ.] / Kevin T. Bush, Hiroyuki Sakurai, Sanjay K. Nigam // Seldin and Giebisch's The Kidney : Physiology and pathophysiology : in 2 vols. / Ed.: R. J. Alpern [et al.]. — Fifth edition. — Amsterdam : Academic Press, 2012, 31 December. — Vol. 1—2. — 3290 p. — ISBN 978-0-12-381463-0, 978-0-12-381462-3. — WD Q114595502.
- Jubb, Kennedy & Palmer's Pathology of Domestic Animals : [англ.]. In 3 vols. Vol. 2 / Ed.: M. Grant Maxie. — Elsevier Health Sciences, 2015, 14 August. — P. 378—379. — ISBN 978-0-7020-5318-4. — WD Q115676233.
- Ecological and Environmental Physiology of Mammals : [англ.] / P. C. Withers, C. E. Cooper, S. K. Maloney [et al.]. — Oxford University Press, 2016. — 590 p. — ISBN 978-0-19-964271-7, 978-0-19-964272-4. — WD Q115609411.
- Breshears M. A. Chapter 11 — The Urinary System : [англ.] : [арх. 30 июля 2022] / M. A. Breshears, A. W. Confer // Pathologic Basis of Veterinary Disease[d] / Ed.: J. F. Zachary. — Sixth Edition. — St. Louis : Elsevier, 2017. — P. 617–681.e1. — ISBN 978-0-323-35775-3. — WD Q115689725.
- Kopp Ulla C. Neural Control of Renal Function : [англ.]. — San Rafael : Morgan & Claypool Life Sciences, 2011, 20 August. — (Integrated Systems Physiology: from Molecule to Function to Disease). — PMID 21850765. — WD Q121112788.
- Kopp Ulla C. Neural Control of Renal Function : [англ.]. — Morgan & Claypool Publishers[d], 2018, 17 July. — 106 p. — (Colloquium Series on Integrated Systems Physiology From Molecule to Function; 1). — ISBN 978-1-61504-776-5, 978-1-61504-775-8, 978-1-61504-777-2. — doi:10.4199/c00161ed2v01y201805isp080. — WD Q122639435.
- Bradley T. J. Animal Osmoregulation : [англ.]. — OUP Oxford, 2009. — P. 121, 164. — (Oxford Animal Biology Series). — ISBN 978-0-19-856996-1. — WD Q115690208.
- Sands Jeff M. 1 Anatomy and Physiology of the Kidneys : [англ.] / Jeff M. Sands, Jill W. Verlander // Toxicology of the Kidney[d] / Ed.: Joan B. Tarloff, Lawrence H. Lash. — Third Edition. — CRC Press, 2004. — P. 3—54. — ISBN 0-203-67329-8, 0-203-64699-1, 0-415-24864-7. — WD Q117066151.
Статьи в журналах
- Schulte K.[d] The evolution of blood pressure and the rise of mankind : [англ.] : [арх. 25 февраля 2022] / K. Schulte, Uta Kunter, Marcus J. Moeller // Nephrology Dialysis Transplantation[d]. — 2014, 18 August. — Vol. 30, iss. 5. — P. 713—723. — ISSN 0931-0509, 1460-2385. — doi:10.1093/ndt/gfu275. — PMID 25140012. — WD Q38241521.
- Laura Keogh. The struggle to equilibrate outer and inner milieus: Renal evolution revisited : [англ.] : [арх. 3 марта 2022] / Laura Keogh, David Kilroy, Sourav Bhattacharjee // Annals of Anatomy[d] : Anatomischer Anzeiger. — 2020, 13 October. — Article 151610. — 15 p. — ISSN 0940-9602, 1618-0402. — doi:10.1016/j.aanat.2020.151610. — PMID 33065247. — WD Q100682336.
- Casotti G. Functional morphology of the avian medullary cone : [англ.] : [арх. 17 марта 2022] / G. Casotti, K. K. Lindberg, E. J. Braun // American journal of physiology. Regulatory, integrative and comparative physiology[d]. — 2000, 1 November. — Vol. 279, iss. 5. — P. R1722—30. — ISSN 0363-6119, 1522-1490. — doi:10.1152/ajpregu.2000.279.5.r1722. — PMID 11049855. — WD Q73118986.
- Balzer Michael S. How Many Cell Types Are in the Kidney and What Do They Do? : [англ.] / Michael S. Balzer, Tibor Rohacs, Katalin Susztak // Annual Review of Physiology[d]. — 2022, 10 February. — Vol. 84. — P. 507—531. — ISSN 0066-4278, 1545-1585. — doi:10.1146/annurev-physiol-052521-121841. — PMID 34843404. — WD Q115632371.
- Abdalla M. A.[d] Anatomical features in the kidney involved in water conservation through urine concentration in dromedaries (Camelus dromedarius) : [англ.] : [арх. 26 июля 2022] // Heliyon[d]. — 2020, 2 January. — Vol. 6, iss. 1. — Article e03139. — ISSN 2405-8440. — doi:10.1016/j.heliyon.2019.e03139. — PMID 31922050. — WD Q92544321.
- Ortiz R. M. Osmoregulation in marine mammals : [англ.] : [арх. 4 июня 2022] // The Journal of Experimental Biology. — 2001, 1 June. — Vol. 204, iss. Pt 11. — P. 1831—1844. — ISSN 0022-0949, 1477-9145. — doi:10.1242/jeb.204.11.1831. — PMID 11441026. — WD Q28205065.
- Renal Lymphatics: Anatomy, Physiology, and Clinical Implications : [англ.] : [арх. 16 сентября 2022] / Peter Spencer Russell, Jiwon Hong, John Albert Windsor [et al.] // Frontiers in Physiology[d]. — 2019. — Vol. 10. — P. 251. — ISSN 1664-042X. — doi:10.3389/fphys.2019.00251. — PMID 30923503. — WD Q64093137.
- Sands J.[d] The physiology of urinary concentration: an update : [англ.] : [рукопись] / J. Sands, Harold E. Layton // Seminars in nephrology[d]. — 2009, 1 May. — Vol. 29, iss. 3. — P. 178—195. — ISSN 0270-9295, 1558-4488. — doi:10.1016/j.semnephrol.2009.03.008. — PMID 19523568. — WD Q37258135.
- Fenton R.[d] Urea and renal function in the 21st century: insights from knockout mice : [англ.] : [арх. 9 марта 2023] / R. Fenton, Mark A Knepper[d] // Journal of the American Society of Nephrology[d]. — 2007, March. — Vol. 18, iss. 3. — P. 679—88. — ISSN 1046-6673, 1533-3450. — doi:10.1681/asn.2006101108. — PMID 17251384. — WD Q28284934.
- Dominique Eladari[d]. Renal acid-base regulation: new insights from animal models : [англ.] / Dominique Eladari, Yusuke Kumai // Pflügers Archiv[d] : European Journal of Physiology. — 2014, 18 December. — Vol. 467, iss. 8. — P. 1623—1641. — ISSN 0031-6768, 1432-2013, 0365-267X. — doi:10.1007/s00424-014-1669-x. — PMID 25515081. — WD Q38290770.
- Alan J Davidson. Uncharted waters: nephrogenesis and renal regeneration in fish and mammals : [англ.] // Pediatric Nephrology[d]. — 2011, 19 February. — Vol. 26, iss. 9. — P. 1435—1443. — ISSN 0931-041X, 1432-198X. — doi:10.1007/s00467-011-1795-z. — PMID 21336813. — WD Q37845213.
- Vize Peter D.[d] A Homeric view of kidney evolution: A reprint of H.W. Smith's classic essay with a new introduction. Evolution of the kidney. 1943. : [англ.] / Peter D. Vize, Homer W. Smith // The Anatomical Record Part A: Discoveries in Molecular, Cellular, and Evolutionary Biology[d]. — 2004, 1 April. — Vol. 277, iss. 2. — P. 344—354. — ISSN 1552-4884, 1552-4892. — doi:10.1002/ar.a.20017. — PMID 15052662. — WD Q48664600.
- Sanjeev Kumar. Cellular and molecular pathways of renal repair after acute kidney injury : [англ.] // Kidney International[d]. — 2018, 1 January. — Vol. 93, iss. 1. — P. 27—40. — ISSN 0085-2538, 1523-1755. — doi:10.1016/j.kint.2017.07.030. — PMID 29291820. — WD Q50424175.
- António Nogueira. Pathophysiological Mechanisms of Renal Fibrosis: A Review of Animal Models and Therapeutic Strategies : [англ.] / António Nogueira, Maria João Pires, Paula Alexandra Oliveira // In Vivo[d] : International journal of experimental and clinical pathophysiology and drug research. — 2017, 1 January. — Vol. 31, iss. 1. — P. 1—22. — ISSN 0258-851X, 1791-7549. — doi:10.21873/invivo.11019. — PMID 28064215. — WD Q37705263.
- The Evolution of the Discrete Multirenculate Kidney in Mammals from Ecological and Molecular Perspectives : [англ.] / Xu Zhou, Wenqi Rong, Boxiong Guo [et al.] // Genome Biology and Evolution[d]. — 2023, 9 May. — Vol. 15, iss. 5. — ISSN 1759-6653. — doi:10.1093/gbe/evad075. — OCLC 710017802. — WD Q122181216.
- Hai-Chun Yang. Kidney regeneration in mammals : [англ.] : [рукопись] / Hai-Chun Yang, Shao-Jun Liu, Agnes B. Fogo // The Nephron Journals[d]. — 2014, 19 May. — Vol. 126, iss. 2. — P. 50. — ISSN 1660-8151, 2235-3186. — doi:10.1159/000360661. — PMID 24854640. — WD Q55210136.
- Little Melissa H.[d] Mammalian kidney development: principles, progress, and projections : [англ.] : [арх. 21 января 2022] / Melissa H. Little, Andrew P. McMahon[d] // Cold Spring Harbor perspectives in biology[d]. — 2012, 1 May. — Vol. 4, iss. 5. — ISSN 1943-0264. — doi:10.1101/cshperspect.a008300. — PMID 22550230. — WD Q35902711.
Дополнительная литература
- C Michele Nawata. Mammalian urine concentration: a review of renal medullary architecture and membrane transporters : [англ.] / C Michele Nawata, Thomas L Pannabecker[d] // Journal of Comparative Physiology B[d] : Biochemical, Systemic, and Environmental Physiology. — 2018, 24 May. — Vol. 188, iss. 6. — P. 899—918. — ISSN 0174-1578, 1432-136X. — doi:10.1007/s00360-018-1164-3. — PMID 29797052. — WD Q88802057.