Принцип Паули

Принцип исключения Паули (принцип запрета Паули или просто принцип запрета) — квантово-механический принцип, который гласит, что два или более тождественных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии в квантовой системе. Этот принцип был сформулирован австрийским физиком Вольфгангом Паули в 1925 году для электронов, а затем распространился на все фермионы в его теореме о связи спина со статистикой в 1940 году[1].
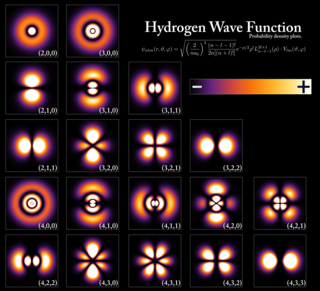
Для случая электронов в атомах его можно сформулировать следующим образом: невозможно, чтобы два электрона многоэлектронного атома имели бы одинаковые значения четырёх квантовых чисел n, (главное квантовое число), l (орбитальное квантовое число), m (магнитное квантовое число) и ms, (квантовое число проекции спина). Например, если два электрона находятся на одной орбитали, то их значения для тройки квантовых чисел n, l, m — одинаковы, поэтому значения ms должны различаться, и, таким образом, электроны должны иметь противоположные проекции спина 1/2 и −1/2 (в единицах h).
На частицы с целочисленным спином или бозоны не распространяется принцип исключения Паули: любое количество идентичных бозонов может занимать одно и то же квантовое состояние, как, например, в случае с фотонами лазерного излучения или атомами в конденсате Бозе — Эйнштейна.
Более строгое утверждение касается обмена двух идентичных частиц: полная (многочастичная) волновая функция антисимметрична для фермионов и симметрична для бозонов. Это означает, что если поменять местами пространственные и спиновые координаты двух одинаковых (тождественных) частиц, то полная волновая функция меняет знак для фермионов и не меняет знака для бозонов.
Если бы два фермиона находились в одном и том же состоянии (например, на одной и той же орбитали атома с одинаковым спином), их перестановка ничего не изменила бы, и полная волновая функция не поменялась бы. Единственная возможность для полной волновой функции изменить знак, как требуется для фермионов, и остаться неизменной, — это равенство её нулю во всей области определения, что означает отсутствие такого состояния. Это рассуждение неприменимо для бозонов, потому что знак полной волновой функции не меняется.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только один фермион, а состояние другого должно отличаться хотя бы одним квантовым числом. В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения . Классический аналог принципа Паули отсутствует[2].
Обзор
Принцип исключения Паули описывает поведение всех фермионов (частиц с «полуцелым спином»), в то время как бозоны (частицы с «целым спином») подчиняются другим принципам. Фермионы включают элементарные частицы, такие как кварки, электроны и нейтрино. Кроме того, барионы, такие субатомные частицы, состоящие из трёх кварков, как протоны и нейтроны и некоторые атомы (например, гелий-3) являются фермионами и, следовательно, также подчиняются принципу запрета. Атомы могут обладать различным полным «спином», который определяет, будут ли они фермионами или бозонами — например, гелий-3 имеет спин 1/2 и, следовательно, является фермионом, в отличие от гелия-4, который имеет спин 0 и является бозоном.[3] :123–125 Таким образом, принцип исключения Паули лежит в основе многих свойств повседневной материи, от её крупномасштабной стабильности до химического поведения атомов.
«Полуцелочисленный спин» означает, что значение собственного углового момента фермионов равно (редуцированная постоянная Планка), умноженная на полуцелое число (1/2, 3/2, 5/2 и т. д.). В квантовой механике фермионы описываются антисимметричными состояниями. В противоположность этому, частицы с целочисленным спином имеют симметричные волновые функции; в отличие от фермионов они могут иметь одни и те же квантовые числа. Бозоны включают фотон, куперовские пары, ответственные за сверхпроводимость, и бозоны W и Z. (Фермионы получили свое название от статистического распределения Ферми — Дирака, которому они подчиняются, а бозоны — от распределения Бозе — Эйнштейна.)
История
В начале XX века стало очевидно, что атомы и молекулы с четным числом электронов более химически стабильны, чем атомы и молекулы с нечетным числом электронов. В статье Гилберта Н. Льюиса от 1916 года «Атом и молекула», например, третий из его шести постулатов о химическом поведении утверждает, что атом имеет тенденцию удерживать чётное число электронов в любой данной оболочке и особенно удерживать восемь электронов, которые, как считается, обычно расположены симметрично в восьми углах куба.[4] В 1919 году химик Ирвинг Ленгмюр предположил, что периодический закон можно объяснить, если электроны в атоме каким-либо образом связаны или сгруппированы. Считалось, что группы электронов занимают набор электронных оболочек вокруг ядра.[5] В 1922 году Нильс Бор развил свою модель атома, предположив, что определённое количество электронов (например, 2, 8 и 18) соответствует стабильным «замкнутым оболочкам».[6] :203
Паули искал объяснение этим числам, которые поначалу были чисто эмпирическими. В то же время он пытался объяснить экспериментальные результаты эффекта Зеемана в атомной спектроскопии и в ферромагнетизме. Он нашел важную подсказку в статье Эдмунда Стонера от 1924 года, в которой указывалось, что для данного значения главного квантового числа (n) количество энергетических уровней одного электрона в спектрах щелочного металла во внешнем магнитное поле, в котором все вырожденные уровни энергии разделены, равно количеству электронов в замкнутой оболочке благородных газов для того же значения n. Это привело Паули к пониманию, что сложное количество электронов в замкнутых оболочках можно свести к простому правилу для одного электрона на состояние, если электронные состояния определены с использованием четырёх квантовых чисел. С этой целью он ввёл новое двузначное квантовое число, идентифицированное Сэмюэлем Гаудсмитом и Джорджем Уленбеком как спин электрона.[7][8]
Связь с симметрией квантового состояния
Принцип исключения Паули с однозначной многочастичной волновой функцией эквивалентен требованию, чтобы волновая функция была антисимметричной по отношению к обмену частицами. Если и пробегают базисные векторы гильбертова пространства, описывающие одночастичную систему, то их тензорное произведение даёт базисные векторы гильбертова пространства, описывающего систему из двух таких частиц. Любое двухчастичное состояние можно представить как суперпозицию (то есть сумму) этих базисных векторов:
где каждый комплексный множитель A(x,y) — скалярный коэффициент. Антисимметрия при обмене частицами означает, что A(x,y) = −A(y,x). Отсюда следует, что A(x,y) = 0 при x = y, что обозначает математическую формулировку принципа исключения Паули. Это верно для любого базиса, так как локальные изменения базиса сохраняют антисимметричные матрицы антисимметричными.
И наоборот, если диагональные величины A(x,x) равны нулю в каждом базисе, то компонента волновой функции
обязательно антисимметрична. Для доказательства рассматривают матричный элемент
С одной стороны это выражение равно нулю, потому что две частицы имеют нулевую вероятность оказаться в состоянии суперпозиции. . Но это также равно
Первый и последний члены являются диагональными элементами и равны нулю, а вся сумма равна нулю. Таким образом, элементы матрицы волновых функций подчиняются:
или
Для системы с n > 2 частицами многочастичные базисные состояния становятся n-кратными тензорными произведениями одночастичных базисных состояний, а коэффициенты волновой функции задаются n одночастичными состояниями. Условие антисимметрии гласит, что коэффициенты должны менять свой знак всякий раз, когда меняются любые два состояния: для любой пары . Принцип исключения — это следствие того, что если для любого тогда Значит, что ни одна из n частиц не может находиться в одном и том же квантовом состоянии.
Продвинутая квантовая теория
Согласно теореме о связи спина со статистикой, квантовые состояния частиц с целым спином описываются симметричными волновыми функциями, а квантовые состояния частиц с полуцелым спином — антисимметричными волновыми функциями. Более того, принципы квантовой механики допускают существования только целых и полуцелых значений спина (в трёхмерном пространстве). В релятивистской квантовой теории поля принцип Паули следует из применения оператора вращения в мнимом времени к частицам с полуцелым спином.
В одном измерении бозоны, как и фермионы, также подчиняются принципу запрета. Одномерный бозе-газ с бесконечной силой отталкивающих дельта-функций эквивалентен газу свободных фермионов. Причина этого в том, что в одном измерении обмен частицами требует, чтобы они проходили друг через друга; при бесконечно сильном отталкивании этого не может произойти. Такая модель описывается квантовым нелинейным уравнением Шредингера. В импульсном пространстве принцип исключения Паули действует также для конечного отталкивания в бозе-газе с дельта-функциональными взаимодействиями[9], а также для взаимодействующих спинов, одномерной модели Хаббарда, и также для других моделей, разрешимых с помощью анзаца Бете. Основным состоянием в моделях, разрешимых анзацем Бете, представляется сферой Ферми.
Приложения
Атомы
Принцип исключения Паули помогает объяснить широкий спектр физических явлений. Одним из особенно важных следствий этого принципа является сложная структура электронной оболочки атомов и способ обмена электронами между атомами, что объясняет разнообразие химических элементов и их химических соединений. В электрически нейтральном атоме количество связанных электронов равно количеству протонов в ядре. Электроны, будучи фермионами, не могут находиться в том же квантовом состоянии, что и другие электроны, поэтому электроны должны иметь разные спины, находясь на одной электронной орбитали, как описано ниже.
Примером может служить нейтральный атом гелия, у которого есть два связанных электрона, каждый из которых может занимать состояния с наименьшей энергией (1s), приобретая, таким образом, противоположные спины. Поскольку спин — это часть квантового состояния электрона, то два электрона находятся в разных квантовых состояниях и не нарушают принцип Паули. Однако спин может принимать только два разных значения (собственные значения). В атоме лития с тремя связанными электронами третий электрон не может находиться в 1s- состоянии и вместо этого должен занимать одно из более высокоэнергетических 2s-состояний. Точно так же последовательно более тяжёлые элементы должны иметь оболочки с более высокой энергией. Химические свойства элемента во многом зависят от количества электронов во внешней оболочке. Атомы с разным числом занятых электронных оболочек, но с одинаковым числом электронов во внешней оболочке обладают схожими свойствами, что лежит в основании свойств химических элементов[10] :214–218.
Чтобы проверить принцип запрета Паули для атома He, Гордон Дрейк[11] очень точно вычислил энергии гипотетических состояний атома He, которые его нарушают, так называемые паронные состояния (парафермионные состояния). Позже К. Дейламиан и соавт.[12] использовали атомно-лучевой спектрометр для поиска паронного состояния 1s2s 1 S 0, рассчитанного Дрейком. Поиск оказался безуспешным и показал, что статистический вес этого паронного состояния имеет верхний предел 5x10 −6 . (Принцип исключения подразумевает нулевой вес.)
Свойства твердого тела
В проводниках и полупроводниках существует очень большое количество молекулярных орбиталей, которые эффективно образуют непрерывную зонную структуру энергетических уровней. В проводниках (металлах) электронный газ настолько вырожден, что даже не могут вносить большой вклад в теплоемкость металла при высоких температурах.[13] :133–147 Многие механические, электрические, магнитные, оптические и химические свойства твердых тел являются прямым следствием исключения Паули.
Устойчивость материи
Стабильность каждого электронного состояния в атоме описывается квантовой теорией атома, которая показывает, что приближение электрона к ядру обязательно увеличивает кинетическую энергию электрона, в согласии с принципом неопределенности Гейзенберга.[14] Однако устойчивость больших систем со многими электронами и многими нуклонами — это другой вопрос, требующий применения принципа запрета Паули.
Было показано, что принцип исключения Паули ответственен также за то, что обычное вещество стабильно и занимает объём. Это предположение впервые высказал в 1931 году Поль Эренфест, который указал, что электроны атома не могут все упасть на орбиталь с наименьшей энергией и должны занимать все более удалённые от ядра оболочки (орбитали с большими главными квантовыми числами). Следовательно, атомы занимают объём и не могут быть сжаты слишком сильно при обычных условиях.[15]
Более строгое доказательство предоставили в 1967 году Фримен Дайсон и Эндрю Ленард (де), которые рассмотрели баланс сил притяжения (электронно-ядерное) и отталкивания (электрон-электронное и ядерно-ядерное) и показали, что обычная материя будет коллапсировать и занимать гораздо меньший объём без принципа Паули.[16][17]
Из принципа Паули следует, что электроны с одним и тем же спином пространственно разделяются отталкивающим обменным взаимодействием, которое является короткодействующим эффектом, действующим совместно с дальнодействующей электростатической или кулоновской силой. Этот эффект частично отвечает за повседневное наблюдение в макроскопическом мире, когда два твердых объекта не могут находиться в одном и том же месте в одно и то же время.
Астрофизика
Дайсон и Ленард не рассматривали экстремальные магнитные или гравитационные силы, возникающие в некоторых астрономических объектах. В 1995 году Эллиот Либ и его коллеги показали, что принцип Паули по-прежнему ведет к стабильности материи в интенсивных магнитных полях, таких как нейтронные звёзды, хотя и при гораздо более высокой плотности, чем в обычном веществе.[18] Из общей теории относительности следует, что при достаточно интенсивных гравитационных полях вещество коллапсирует, образуя черную дыру.
Астрономия даёт впечатляющие примеры демонстрирующие влияние принципа Паули на материю в виде белых карликов и нейтронных звёзд. В обоих телах атомная структура нарушена экстремальным давлением, но звёзды удерживаются в гидростатическом равновесии за счёт давления вырождения, также известного как давление Ферми. Эта экзотическая форма материи известна как вырожденная материя. Огромная гравитационная сила массы звезды обычно удерживается в равновесии за счёт теплового давления, вызванного теплом, выделяемым при термоядерном синтезе в ядре звезды. В белых карликах, в которых не происходят реакции ядерного синтеза, сила, противодействующая гравитации, обеспечивается давлением вырождения электронов. В нейтронных звёздах, подверженных ещё более сильным гравитационным силам, электроны слились с протонами, образуя нейтроны. Нейтроны способны создавать ещё более высокое давление вырождения, давление вырождения нейтронов, хотя и в более узком диапазоне. Это стабилизирует нейтронные звезды от дальнейшего коллапса, но при меньшем размере и более высокой плотности, чем в белых карликах. Нейтронные звезды — самые «жёсткие» известные объекты; их модуль Юнга (точнее, объёмный модуль упругости) на 20 порядков больше, чем у алмаза. Однако даже эту огромную жёсткость можно преодолеть гравитационным полем нейтронной звезды, масса которого превышает предел Толмана — Оппенгеймера — Волкова, что приводит к образованию чёрной дыры.[19] :286–287
Примечания
- ↑ В. Паули Принцип запрета, группа Лоренца, отражение пространства, времени и заряда // Нильс Бор и развитие физики. — М., ИЛ, 1958. — c. 46-74
- ↑ Физика микромира. — М., Советская энциклопедия, 1980. — с. 304
- ↑ Kenneth S. Krane. Introductory Nuclear Physics. — Wiley, 5 November 1987. — ISBN 978-0-471-80553-3.
- ↑ Linus Pauling and The Nature of the Chemical Bond: A Documentary History. Special Collections & Archives Research Center - Oregon State University. Дата обращения: 19 марта 2021. Архивировано 3 ноября 2013 года.
- ↑ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules" (PDF). Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002. Архивировано из оригинала (PDF) 30 марта 2012. Дата обращения: 1 сентября 2008.
- ↑ Shaviv, Glora. The Life of Stars: The Controversial Inception and Emergence of the Theory of Stellar Structure. — Springer, 2010. — ISBN 978-3642020872.
- ↑ Straumann, Norbert (2004). "The Role of the Exclusion Principle for Atoms to Stars: A Historical Account". Invited Talk at the 12th Workshop on Nuclear Astrophysics. arXiv:quant-ph/0403199. Bibcode:2004quant.ph..3199S.
- ↑ Pauli, W. (1925). "Über den Zusammenhang des Abschlusses der Elektronengruppen im Atom mit der Komplexstruktur der Spektren". Zeitschrift für Physik. 31 (1): 765—783. Bibcode:1925ZPhy...31..765P. doi:10.1007/BF02980631.
- ↑ A. G. Izergin (July 1982). "Pauli principle for one-dimensional bosons and the algebraic bethe ansatz" (PDF). Letters in Mathematical Physics. 6 (4): 283—288. Bibcode:1982LMaPh...6..283I. doi:10.1007/BF00400323. Архивировано (PDF) 25 ноября 2018. Дата обращения: 19 марта 2021.
- ↑ Griffiths, David J. (2004), Introduction to Quantum Mechanics (2nd ed.), Prentice Hall, ISBN 0-13-111892-7
- ↑ Drake, G.W.F. (1989). "Predicted energy shifts for "paronic" Helium". Phys. Rev. A. 39 (2): 897—899. Bibcode:1989PhRvA..39..897D. doi:10.1103/PhysRevA.39.897. PMID 9901315. Архивировано 3 марта 2021. Дата обращения: 19 марта 2021.
- ↑ Deilamian, K. (1995). "Search for small violations of the symmetrization postulate in an excited state of Helium". Phys. Rev. Lett. 74 (24): 4787—4790. Bibcode:1995PhRvL..74.4787D. doi:10.1103/PhysRevLett.74.4787. PMID 10058599.
- ↑ Kittel, Charles (2005), Introduction to Solid State Physics (8th ed.), USA: John Wiley & Sons, Inc., ISBN 978-0-471-41526-8
- ↑ Lieb, Elliott H. (2002). "The Stability of Matter and Quantum Electrodynamics". arXiv:math-ph/0209034. Bibcode:2002math.ph...9034L.
{{cite journal}}: Cite journal требует|journal=() - ↑ As described by F. J. Dyson (J.Math.Phys. 8, 1538—1545 (1967)), Ehrenfest made this suggestion in his address on the occasion of the award of the Lorentz Medal to Pauli.
- ↑ F. J. Dyson and A. Lenard: Stability of Matter, Parts I and II (J. Math. Phys., 8, 423—434 (1967); J. Math. Phys., 9, 698—711 (1968))
- ↑ Dyson, Freeman (1967). "Ground‐State Energy of a Finite System of Charged Particles". J. Math. Phys. 8 (8): 1538—1545. Bibcode:1967JMP.....8.1538D. doi:10.1063/1.1705389.
- ↑ Lieb, E. H. (1995). "Stability of Matter in Magnetic ields". Physical Review Letters. 75 (6): 985—9. arXiv:cond-mat/9506047. Bibcode:1995PhRvL..75..985L. doi:10.1103/PhysRevLett.75.985. PMID 10060179.
- ↑ Martin Bojowald. The Universe: A View from Classical and Quantum Gravity. — ISBN 978-3-527-66769-7.
Литература
- Паули В. «О связи между заполнением групп электронов в атоме и сложной структурой спектров» (Получена 16 января 1925) в книге «Вольфганг Паули Труды по квантовой теории: Квантовая теория. Общие принципы волновой механики. Статьи 1920—1928.» М.: Наука, 1975. стр.645-660
- Pauli W. Uber den Zusammenhang des Abschlusses der Elektronengruppen in Atom mit der Коmplexstruktur der Spektren,— Z. Phys., 1925, 31, 765—783.
- Паули В. Общие принципы волновой механики. — М.—Л. : ГИТТЛ, 1947.
- Давыдов А. С. Квантовая механика. — Наука, 1973. — С. 334.