Митохо́ндрия — двумембранная сферическая или эллипсоидная органелла диаметром обычно около 1 микрометра. Характерна для большинства эукариотических клеток, как автотрофов, так и гетеротрофов. Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии для генерации электрического потенциала, синтеза АТФ и термогенеза. Эти три процесса осуществляются за счёт движения электронов по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300 000 и 500 000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют. В специализированных клетках органов животных содержатся сотни и даже тысячи митохондрий.

Гиббереллины — группа фитогормонов дитерпеновой природы, которые выполняют в растениях разнообразные функции, связанные с контролем удлинения гипокотиля, прорастания семян, зацветания и т. д. В контроле большинства морфогенетических процессов гиббереллины действуют в одном направлении с ауксинами и являются антагонистами цитокининов и абсцизовой кислоты (АБК).

Цитохром — небольшой гем-содержащий белок, относится к классу цитохромов, содержит в структуре гем типа c. Выполняет в клетке две функции. С одной стороны, он является одноэлектронным переносчиком, свободно связанным с внутренней мембраной митохондрий, и необходимым компонентом дыхательной цепи. Он способен окисляться и восстанавливаться, но не связывает при этом кислород. С другой стороны, при определённых условиях он может отсоединяться от мембраны, переходить в раствор в межмембранном пространстве и активировать апоптоз. Такая двойственность связана со специфичными свойствами молекулы цитохрома c.
Дыхательная цепь переноса электронов, также электрон-транспортная цепь (сокр. ЭТЦ, англ. ETC, Electron transport chain) — система трансмембранных белков и переносчиков электронов, необходимых для поддержания энергетического баланса. ЭТЦ поддерживает баланс за счёт переноса электронов и протонов из НАД∙Н и ФАДН2 в акцептор электронов. В случае аэробного дыхания акцептором может быть молекулярный кислород (О2). В случае анаэробного дыхания акцептором могут быть NO3−, NO2−, Fe3+, фумарат, диметилсульфоксид, сера, SO42−, CO2 и т. д. ЭТЦ у прокариот локализована в ЦПМ, у эукариот — на внутренней мембране митохондрий. Переносчики электронов расположены в порядке уменьшения сродства к электрону, то есть по своему окислительно-восстановительному потенциалу, где у акцептора самое сильное сродство к электрону. Поэтому транспорт электрона на всём протяжении цепи протекает самопроизвольно с выделением энергии. Выделение энергии в межмембранное пространство при переносе электронов происходит ступенчато, в виде протона (H+). Протоны из межмембранного пространства попадают в протонную помпу, где наводят протонный потенциал. Протонный потенциал преобразуется АТФ-синтазой в энергию химических связей АТФ. Сопряжённая работа ЭТЦ и АТФ-синтазы носит название окислительного фосфорилирования.

Пероксисо́ма — клеточная органелла, окружённая единственной мембраной и не содержащая ДНК и рибосом. Пероксисомы присутствуют во всех эукариотических клетках. Они содержат ферменты, которые при помощи молекулярного кислорода окисляют некоторые органические вещества. В пероксисомах также происходит β-окисление жирных кислот. В них также протекают первые этапы образования плазмалогенов. У растений пероксисомы клеток листьев участвуют в процессе фотодыхания. Импорт белков в пероксисомы происходит при участии короткой сигнальной последовательности.

Оксидаза D-аминокислот - фермент, окисляющий D-аминокислоты. DAAO обнаруживается в пероксисомах и представляет собой FAD-содержащий флавопротеин.

Цитохром-c-оксида́за (цитохромоксидаза) или цитохром-c-кислород:оксидоредуктаза, также известная как цитохром aa3 и комплекс IV — терминальная оксидаза аэробной дыхательной цепи переноса электронов, которая катализирует перенос электронов с цитохрома с на кислород с образованием воды. Цитохромоксидаза присутствует во внутренней мембране митохондрий всех эукариот, где её принято называть комплекс IV, а также в клеточной мембране многих аэробных бактерий.

Плейотропи́я — явление множественного действия гена. Выражается в способности одного гена влиять на несколько фенотипических признаков. Таким образом, новая мутация в гене может оказать влияние на некоторые или все связанные с этим геном признаки. Этот эффект может вызвать проблемы при селективном отборе, когда при отборе по одному из признаков лидирует один из аллелей гена, а при отборе по другим признакам — другой аллель этого же гена.

Цитохром P450 3A4 (сокращённо CYP3A4) — один из наиболее важных ферментов, участвующих в метаболизме ксенобиотиков в организме человека, в основном находится в печени и кишечнике. Его целью является окисление небольших чужеродных органических молекул, таких как токсины или лекарства, с тем, чтобы их можно было вывести из организма. У людей бело́к CYP3A4 кодируется ге́ном CYP3A4. Этот ген является частью кластера генов цитохрома P450 на хромосоме 7q21.1.
Декарбоксилаза ароматических аминокислот — фермент (энзим), участвующий в процессе органического декарбоксилирования.

Протопорфирин IX — органическое вещество класса порфиринов, синтезируется при метаболизме порфирина ферментом протопорфириноген IX оксидаза.
Альтернати́вная оксида́за (AO) — фермент, обеспечивающий альтернативный транспорт электронов в митохондриях всех семенных растений, грибов, а также водорослей, некоторых простейших и ряда малоподвижных или прикреплённых животных. Гомологи этого белка были обнаружены в геномах многих бактерий. Биоинформатическими методами удалось выявить альтернативную оксидазу во всех царствах, кроме архей.
Терминальная оксидаза, или альтернативная оксидаза пластид, — фермент, который находится на стромальной стороне тилакоидной мембраны в хлоропластах растений и водорослей и внутриклеточных впячиваниях цитоплазматической мембраны цианобактерий. Впервые гипотеза о его существовании была высказан в 1982 году, и подтвердилась годами позже, после открытия в мембране тилакоида фермента, аминокислотная последовательность которого была сходной с таковой у альтернативной оксидазы митохондрий. Обе оксидазы произошли от общего предшественника — белка прокариот, и настолько схожи в структурном и функциональном плане, что помещённая в тилакоид альтернативная оксидаза может заменить выключенную терминальную оксидазу.

Амитрол или 3-АТ — неселективный системный гербицид из группы триазолов.
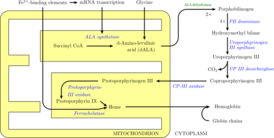
АЛК-синтаза, также синтаза аминолевулиновой кислоты (англ. ALA synthase, ALAS) — фермент (КФ 2.3.1.37), из семейства ацилтрансферазы (класс трансфераз), встречается у нерастительных организмов (животных и α-протеобактерий) и катализирует реакцию синтеза δ-аминолевулиновой кислоты (дАЛК или АЛК) из глицина и сукцинил-КоА, путём их конденсации:
- сукцинил-КоА + глицин
 δ-аминолевулиновая кислота + КоА + CO2.
δ-аминолевулиновая кислота + КоА + CO2.

Феррохелатаза, также протопорфирин феррохелатаза или протогем ферро-лиаза (протопорфиринобразующая) — фермент (КФ 4.98.1.1 ) из класса лиаз, который катализирует последнюю (8-ю) реакцию биосинтеза гема — превращение молекул протопорфирина IX в гем Б. У человека фермент кодируется геном FECH, локализованный на коротком плече (p-плече) 18-й хромосомы. Реакция, катализируемая данным ферментом:
- протогем (гем Б) + 2H+ = протопорфирин IX + Fe+2.

АЛК-дегидратаза, также дегидратаза δ-аминолевулиновой кислоты или порфобилиногенсинтаза — фермент семейства дегидратаз, который катализирует асимметричную реакцию межмолекулярной конденсации и циклизации аминолевулиновой кислоты в порфобилиноген. У человека данный фермент кодируется одноимённым геном ALAD, который располагается на коротком плече (p-плече) 9-й хромосомы. Все природные тетрапирролы, включая гемы, хлорофиллы и витамин B12, зависят от синтеза порфобилиногена, так как он является общим предшественником данных соединений. Порфобилиногенсинтаза является прототипом морфеина. АЛК-дегидратаза локализована практически во всех клетках организма человека, но особенно много её в цитозоле эритропоэтических клеток красного костного мозга и в гепатоцитах печени.

Биосинтез гема — метаболический многоступенчатый процесс образования молекул гема из его предшественников. Гем представляет собой плоский железосодержащий макроциклический комплекс, основу которого составляет четыре пиррольных кольца (тетрапиррол), объединённые между собой метениловыми мостиками (=СH-) и координированные двухвалентным железом (Fe2+). Гем имеет несколько типов, они отличаются как структурно, так и функционально. Но наиболее распространённым типом гема, является — гем Б.

Уропорфириноген III декарбоксилаза, также уропорфириноген декарбоксилаза (сокр. УПГ-III-декарбоксилаза) — фермент (КФ 4.1.1.37) из семейства декарбоксилазы (класс лиазы), катализирует реакцию декарбоксилирования молекул уропорфириногена III в копропорфириноген III. Реакция имеет следующий вид:
- уропорфириноген III
 копропорфириноген III + 4CO2.
копропорфириноген III + 4CO2.
Копропорфириноген III оксидаза, сокр. КПГ-III-оксидаза (англ. Coproporphyrinogen-III oxidase, сокр. CPOX) — фермент (КФ 1.3.3.3) семейства оксидаз (класс оксидоредуктазы), катализирующий реакцию окислительного декарбоксилирования копропорфориногена III в протопорфириноген IX. Схема реакции:
- копропорфириноген III + 2O2 + 2H+ → протопорфириноген IX + 2H2O + 2CO2