п-Фенилендиамин
| п-Фенилендиамин[1][2] | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | 1,4-фенилендиамин |
| Хим. формула | C6H8N2 |
| Рац. формула | C6H4(NH2)2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 108,14 г/моль |
| Энергия ионизации | 663 кДж/моль |
| Термические свойства | |
| Температура | |
| • плавления | 146 °C |
| • кипения | 267 °C |
| • вспышки | 156 °C |
| Давление пара | 1,08 мм рт. ст. (100 °C) |
| Химические свойства | |
| Растворимость | |
| • в воде | 3,824 г/100 мл |
| Классификация | |
| Рег. номер CAS | 106-50-3 |
| PubChem | 24898724 |
| Рег. номер EINECS | 203-404-7 |
| SMILES | |
| InChI | |
| RTECS | SS8050000 |
| ChEBI | 51403 |
| ChemSpider | 13835179 |
| Безопасность | |
| ЛД50 | 80 мг/кг (мыши, перорально) |
| Фразы риска (R) | R23/24/25, R36, R43, R50/53 |
| Фразы безопасности (S) | S28, S36/37, S45, S60, S61 |
| Краткие характер. опасности (H) | H301, H311, H317, H319, H331, H410 |
| Меры предостор. (P) | P261, P273, P280, P301+P310, P305+P351+P338, P311 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
пара-Фенилендиамин — органическое соединение, ароматический диамин 1,4-C6H4(NH2)2.
Получение и лабораторная очистка
Наиболее важные способы синтеза п-фенилендиамина основаны на реакциях гидрирования 4-нитроанилина и диазотировании анилина. В первом методе 4-хлорнитробензол аминируется аммиаком с образованием нитроанилина, который затем гидрируется на палладиевом катализаторе:
Недостатком этого метода является неоптимальное соотношение изомеров в реакции получения исходного вещества: при нитровании хлорбензола соотношение орто- и пара-изомеров составляет 65:35[3].
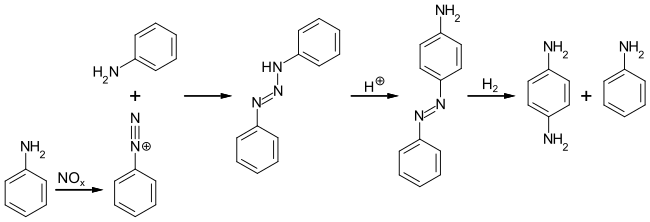
Второй метод, разработанный DuPont, начинается с диазотирования анилина оксидами азота. Образующееся диазосоединение реагирует с избытком анилина, давая 1,3-дифенилтриазен, который в кислой среде перегруппировывается в 4-аминоазобензол. Последний затем каталитически расщепляется и гидрируется с образованием п-фенилендиамина и анилина. Анилин выделяют и используют в синтезе повторно[3]:
Существует метод, в котором для синтеза п-фенилендиамина используется диметилтерефталат или отходы полиэтилентерефталата. При реакции этих соединений с аммиаком получается терефталамид, который затем хлорируют и обрабатывают гидроксидом натрия, и в результате перегруппировки Гофмана образуется п-фенилендиамин[3].
В лаборатории п-фенилендиамин очищают кристаллизацией из этанола или бензола и последующей сублимацией в вакууме. Вещество необходимо оберегать от солнечных лучей[4].
Физические свойства
п-Фенилендиамин легко растворим в горячей воде, а также основны́х органических растворителях (спиртах, кетонах и эфирах). Поскольку он плохо растворим в холодной воде, его можно кристаллизовать из воды[3].
Химические свойства
п-Фенилендиамин проявляет свойства типичного ароматического амина, например, действует в водных растворах как основание и образует устойчивые соли. На воздухе он быстро окисляется (быстрее, чем орто- и мета-изомеры). Окисление диоксидом марганца и дихроматом калия приводит к бензохинону. Если п-фенилендиамин окислять пероксидом водорода, то на первой стадии образуется п-бензохинондиимин, который реагирует с исходным диамином с образованием коричневого красителя — основания Бандровского (параазофенилена?). Этот диимин вступает в реакции и с другими ароматическими аминами и фенолами, давая ряд красителей. Реакции по аминогруппам включают диазотирование, алкилирование, ацилирование и др.[3].
Применение
п-Фенилендиамин применяется в производстве арамидных полимерных волокон (кевлар), которые используются для армирования шин, пластиков и в других приложениях, где необходимы высокая прочность и модуль упругости. По реакции п-фенилендиамина с фосгеном синтезируют п-фенилендиизоцианат — исходное сырьё для синтеза различных полиуретанов. Также п-фенилендиамин находит применение в синтезе красителей, в том числе красок для волос[3].
В фотографии — может использоваться как проявляющее вещество для мелкозернистого проявления, обычно вместе с другими проявляющими веществами. Проявление начинается при значении pH более 6,25[5]. Также является цветным проявляющим веществом, но практически в этой роли не используется, так как не удовлетворяет требованиям, необходимым для получения качественного изображения; вместо этого применяются его производные, например: ЦПВ-1, ЦПВ-2[6][7].
Токсичность
Токсические эффекты от вдыхания, наблюдаемые на животных, включают тремор, цианоз и сильное уменьшение веса. Вещество не обладает канцерогенным действием. Характерным свойством п-фенилендиамина является то, что в присутствии воздуха и влаги он весьма легко образует красители, поэтому предметы, контактировавшие с ним, будь то кожа, одежда или стены, окрашиваются в тёмно-синий цвет. Это свойство используется на производствах для обнаружения недостаточных гигиенических условий при работе с этим веществом[3].
Примечания
- ↑ Sigma-Aldrich. p-Phenylenediamine. Дата обращения: 9 января 2014. Архивировано 8 ноября 2015 года.
- ↑ Dean J. A. Lange's Handbook of Chemistry. — McGraw-Hill, 1999. — ISBN 0-07-016384-7.
- ↑ 1 2 3 4 5 6 7 Smiley R. A. Phenylene- and Toluenediamines // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley. — 2000. — doi:10.1002/14356007.a19_405.
- ↑ Amarego W. L. F., Chai C. L. L. Purification of Laboratory Chemicals. — Sixth ed. — Elsevier, 2009. — P. 329. — ISBN 978-1-85617-567-8.
- ↑ Редько А.В. Основы фотографических процессов. — Лань, 1999. — С. 498.
- ↑ Mees, 1942, с. 364.
- ↑ Хант, 2009, с. 361.
Литература
- Хант Р. В. Г. Цветовоспроизведение / пер. А. Е. Шадрин. — 6-е изд.. — СПб., 2009. — 887 с.
- Mees C. E. K. The theory of photographic process (англ.). — New York: The Macmillan Company, 1942.
Ссылки
- Sigma-Aldrich. ЯМР-спектр п-фенилендиамина. Дата обращения: 9 января 2014. Архивировано 10 января 2014 года.
- Sigma-Aldrich. ИК-спектр п-фенилендиамина. Дата обращения: 9 января 2014. Архивировано 10 января 2014 года.
- Sigma-Aldrich. КР-спектр п-фенилендиамина. Дата обращения: 9 января 2014. Архивировано 10 января 2014 года.