РНК-интерференция

РНК-интерференция (англ. RNA interference, RNAi) — процесс подавления экспрессии гена на стадии транскрипции, трансляции, деаденилирования или деградации мРНК при помощи малых молекул РНК.
Процессы РНК-интерференции обнаружены в клетках многих эукариот: у животных, растений и грибов. Система РНК-интерференции играет важную роль в защите клеток от вирусов, паразитирующих генов (транспозонов), а также в регуляции развития, дифференцировки и экспрессии генов организма.
Процесс РНК-интерференции начинается с действия фермента Dicer, который разрезает длинные молекулы двуцепочечной РНК (dsRNA) на короткие фрагменты порядка 21—25 нуклеотидов, называемые siRNA. Одну из двух цепочек каждого фрагмента называют «направляющей», эта одноцепочечная РНК далее включается в состав РНК-белкового комплекса RISC. В результате активности RISC одноцепочечный фрагмент РНК соединяется с комплементарной последовательностью молекулы мРНК и вызывает разрезание мРНК белком Argonaute либо ингибирование трансляции и/или деаденилирование мРНК. Эти события приводят к подавлению экспрессии (сайленсингу) соответствующего гена, эффективность которого ограничена концентрациями молекул малых РНК — siRNA и микроРНК.
Селективный эффект РНК-интерференции на экспрессию генов делает RNAi полезным инструментом для исследований с использованием культур клеток и живых организмов, так как синтетические двуцепочечные РНК, введённые в клетки, вызывают супрессию специфических генов. RNAi используется для крупномасштабных исследований в области молекулярной биологии, биохимии, биотехнологии и медицины. Так, например, РНК-интерференцию используют для систематического «выключения» генов в клетках и установления функций генов при изучении деления клетки.
Исторически РНК-интерференция была известна под названием посттранскрипционного сайленсинга генов. Только после того, как эти предположительно несвязанные процессы были исследованы, стало ясно, что все они описывали проявления RNAi. В 2006 году американские учёные Эндрю Файер и Крейг Мелло получили Нобелевскую премию в области физиологии и медицины за работы по изучению РНК-интерференции у нематоды Caenorhabditis elegans[1], опубликованные в 1998 году[2].
История

До открытия РНК-интерференции у растений были описаны факты ингибирования транскрипции антисмысловыми РНК[4]. В 1990 году для того, чтобы изменить окраску цветков петунии (Petunia hybrida), в растения были введены дополнительные копии гена халконсинтазы — фермента, необходимого для синтеза розового и фиолетового пигментов. Однако, повышение экспрессии гена синтазы не привело к проявлению более тёмной окраски околоцветника, напротив, цветки стали более светлыми и даже частично белыми. Полученные результаты свидетельствовали о том, что активность фермента не растёт, а снижается. Гены халконсинтазы экспрессировались на более низком уровне, чем до введения трансгена.[5][6] Через некоторое время «подавление гена» было описано у гриба Neurospora crassa, однако данный процесс не был соотнесён с процессами, описанными для растений[7]. Дальнейшие исследования показали, что у растений деградация мРНК приводит к снижению активности гена по механизму посттранскрипционного ингибирования[8]. Данное явление получило название «косупрессии экспрессии гена», однако, механизм данного процесса не был известен[9].
Подобный неожиданный эффект был описан при попытке повышения устойчивости растений к вирусам. Было известно, что растения, экспрессирующие вирусные белки, имеют повышенную устойчивость к вирусной инфекции, однако дальнейшие исследования показали, что устойчивость к инфицированию другими вирусами обеспечивается лишь короткими участками некодирующих вирусных РНК. Исследователи также полагали, что трансгенные вирусные РНК могут также ингибировать репликацию вирусов[10]. Обратный эксперимент, в ходе которого короткие последовательности генов растений были введены в геном вируса, показал, что происходит супрессия генов-мишеней в заражённых растениях. Данный феномен был назван «сайленсингом генов, вызванным вирусами» (англ. virus-induced gene silencing, VIGS), а совокупность подобных явлений была названа посттранскрипционным сайленсингом генов (англ. post transcriptional gene silencing)[11].
После наблюдений, сделанных на растениях, многие лаборатории по всему миру пытались обнаружить подобное явление в других организмах[12][13]. Крейг Мелло и Эндрю Файер в статье в журнале Nature в 1998 году описали эффект сайленсинга генов после введения двуцепочечной РНК в организм круглого червя Caenorhabditis elegans[2]. В исследованиях по регуляции синтеза мышечных белков Мелло и Файера показали, что введение мРНК или антисмысловых РНК не влияло на синтез белка, в то время как введение двуцепочечных РНК успешно снижало экспрессию гена-мишени. Результатом этих работ стало появление термина РНК-интерференция. Исследования Файера и Мелло примечательны тем, что в ходе их работы было выявлено действующее начало системы посттранскрипционного сайленсинга генов. В 2006 году за исследования в области РНК-интерференции Файер и Мелло получили Нобелевскую премию в области физиологии и медицины[1].
Компоненты
Рибонуклеиновый компонент системы РНК-интерференции может быть представлен эндогенными и экзогенными короткими двуцепочечными олигонуклеотидами двух типов — микроРНК и малыми интерферирующими РНК (англ. small interfering RNA, siRNA).
Малые интерферирующие РНК
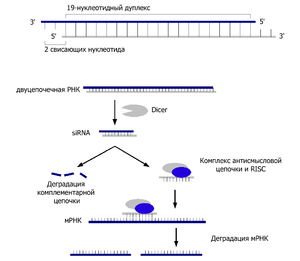
Малые интерферирующие РНК представляют собой двуцепочечные РНК длиной 21—25 нуклеотидов с двумя неспаренными выступающими нуклеотидами на 3'-концах. Каждая цепочка нуклеотидов имеет фосфатную группу на 5'-конце и гидроксильную группу на 3'-конце. Такая структура siRNA образуется в результате активности фермента Dicer, субстратом которого являются длинные двуцепочечные РНК или короткие РНК, содержащие шпильки[14]. Дуплексы малых интерферирующих РНК поступают далее в каталитический комплекс RISC, где при участии белка Argonaute происходит расплетение дуплекса и образование комплементарного комплекса короткой антисмысловой РНК со специфической последовательностью в кодирующей области мРНК, что приводит к дальнейшей деградации последней. В отличие от микроРНК, малые интерферирующие РНК, как правило, точно спариваются с мишенью и приводят к эндонуклеолитическому расщеплению единственной специфической мРНК[15]
МикроРНК

МикроРНК (англ. MicroRNA, miRNA) представляют собой некодирующие РНК длиной 21—22 нуклеотида, принимающие участие в регуляции экспрессии генов. МикроРНК связываются со специфическими последовательностями мРНК в 3'-нетранслируемой области и вызывают ингибирование трансляции либо удаление поли(А)-хвоста. Молекулы микроРНК экспрессируются в виде первичных транскриптов длинных генов, кодирующих предшественники микроРНК (англ. pri-miRNA, primordial miRNA), и после процессинга в ядре клетки представляют собой pre-miRNA — структуры вида стебелёк-петля длиной около 70 нуклеотидов. Комплекс процессинга pri-miRNA в pre-miRNA содержит фермент с активностью РНКазы III, называемый Drosha, и белок, связывающий двуцепочечную РНК, — Pasha. Двуцепочечная часть pre-miRNA связывается и разрезается белком Dicer (у Drosophila melanogaster микроРНК и малые интерферирующие РНК процессируются разными изоформами фермента Dicer[16]); при этом образуется зрелая молекула микроРНК, которая может далее поступать в RISC[17][18][19]. Известен также путь образования микроРНК, независимый от Dicer. Процессинг предшественника микроРНК в данном случае осуществляется белком Argonaute 2[20][21].
У животных микроРНК обычно имеют неполное спаривание с мРНК-мишенью и могут ингибировать трансляцию многих мРНК со сходными последовательностями. У растений спаривание во многих случаях может быть полным.
RISC

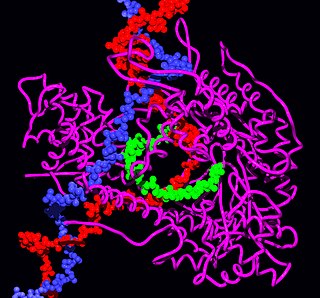
Каталитической частью RISC (комплекс сайленсинга, индуцированный РНК англ. RNA-induced silencing complex) являются белки-эндонуклеазы семейства Argonaute, которые разрезают мРНК, комплементарные связанной малой интерферирующей РНК[1]. Так как фрагменты, которые образуются после разрезания белком Dicer являются двуцепочечными, потенциально каждая из цепочек может являться малой интерферирующей РНК (англ. siRNA). Однако, лишь одна из двух цепочек, называемая ведущей цепочкой (англ. guide strand) связывается с белком Argonaute и подавляет экспрессию гена. Другая цепочка, называемая цепочкой-спутницей (англ. passenger strand, anti-guide strand) подвергается деградации во время активации RISC[22]. Хотя ранее считалось, что цепочки разделяет АТФ-зависимая геликаза[23], в настоящее время показано, что данный процесс является АТФ-независимым и осуществляется непосредственно белками, входящими в состав RISC[24][25]. Выбор направляющей цепочки не зависит от направления, в котором Dicer разрезает двуцепочечную РНК до поступления в RISC[26][27]. Белок R2D2 может являться фактором, различающим при связывании более стабильный 5'-конец цепочки-спутницы[28].
При помощи рентгеноструктурного анализа изучено связывание молекул РНК с РНК-связывающим доменом белка семейства Argonaute. При этом фосфорилированный 5'-конец одноцепочечной РНК попадает в консервативный карман белка, где 5'-концевой фосфат удерживается координационными связями при участии иона Mg2+, а адениновый остаток вступает в стекинг-взаимодействия с консервативным остатком тирозина. Данный участок белка, по-видимому, стимулирует связывание малых интерферирующих РНК с мишенью мРНК[29].
К настоящему времени механизм, по которому RISC находит комплементарную мРНК внутри клетки, изучен недостаточно. Показано, что для успешной деградации мРНК комплексом siRISC трансляция не требуется[30]. Более того, показано, что путь РНК-интерференции может быть более эффективным против мРНК-мишеней, трансляция которых не осуществляется в текущий момент времени[31]. Белки семейства Argonaute являются каталитическим компонентом RISC, и находятся в специфических районах цитоплазмы, известных как Р-тельца (англ. P-bodies)[32]; показано, что активность малых интерферирующих РНК и деградация мРНК максимальны именно в Р-тельцах[33]. Р-тельца являются важной частью системы РНК-интерференции. Их разрушение приводит к снижению эффективности данного процесса.[34].
Механизм

РНК-интерференция является РНК-зависимым процессом сайленсинга генов, который контролируется RISC. RISC активируется в цитоплазме клетки, где короткие двуцепочечные молекулы РНК взаимодействуют с каталитическим компонентом RISC — белком Argonaute[1]. В случае, когда двуцепочечная РНК является экзогенной (появляется в результате лабораторных манипуляций или инфицирования РНК-содержащим вирусом), РНК оказывается непосредственно в цитоплазме, где разрезается на короткие фрагменты (siRNA) белком Dicer, и образующийся siRNA-содержащий функциональный комплекс называется siRISC. В случае пре-микроРНК, экспрессирующихся с генов некодирующих РНК, RNAi запускается эндогенной двуцепочечной РНК. Первичные транскрипты таких генов сначала процессируются в ядре с образованием пре-микроРНК, содержащих специфические структуры «стебель-петля». Пре-микроРНК затем экспортируются в цитоплазму и разрезаются белком Dicer с образованием микроРНК, которые включаются в состав микроРНК-содержащего комплекса, называемого miRISC. Таким образом, RISC является местом, где пересекаются два пути РНК-интерференции, индуцированные экзогенными и эндогенными двуцепочечными РНК[36].
Разрезание двуцепочечных РНК

Экзогенная двуцепочечная РНК запускает систему РНК-интерференции, активируя фермент-рибонуклеазу Dicer[14], который связывает и разрезает РНК-дуплексы, при этом образуются siRNA-двуцепочечные фрагменты длиной 21—25 пар нуклеотидов, с несколькими неспаренными основаниями на каждом конце[38][39][40][41]. Биоинформационный анализ геномов многих организмов предполагает, что такая длина siRNA увеличивает их специфичность к гену-мишени и снижает вероятность неспецифического связывания[42]. Далее siRNA разделяются на отдельные цепочки и вовлекаются в RISC (siRISC). После интеграции в RISC, siRNA комплементарно соединяются с мРНК-мишенью и вызывают разрезание мРНК, таким образом предотвращая её трансляцию[43].
Экзогенная двуцепочечная РНК узнаётся и связывается специальными эффекторными белками (например, RDE-4 у Caenorhabditis elegans и R2D2 у Drosophila), усиливающими активность белка Dicer[44]. Эти эффекторные белки связываются лишь с длинными двуцепочечными РНК, однако механизм сродства к таким субстратам неизвестен[44]. Такие РНК-связывающие белки облегчают перенос разрезанных siRNA к комплексу RISC[45].
У Caenorhabditis elegans путь инициации РНК-интерференции в клетке может быть усилен в результате синтеза «вторичных» siRNA на матрице «первичных» малых интерферирующих РНК[46]. «Вторичные» siRNA отличаются по структуре от образовавшихся в результате активности белка Dicer, и, по-видимому, синтезируются РНК-зависимой РНК-полимеразой (англ. RNA-dependent RNA Polymerase, RdRP)[47][48].
Сайленсинг транскрипции
Многие эукариоты используют систему РНК-интерференции для поддержания структуры генома. Химическая модификация гистонов и переход соответствующих участков хромосом в состояние гетерохроматина приводит к снижению транскрипции соответствующих генов[49]; данный процесс относится к сайленсингу транскрипции, индуцированному РНК (англ. RNA-induced transcriptional silencing, RITS), и осуществляется сложным комплексом белков. В делящихся дрожжах данный комплекс содержит Argonaute, белок с хромодоменом Chp1, и белок, называемый Tas3 с неизвестной функцией[50]. Как следствие, индукция и расширение гетерохроматиновых участков требует наличия белков Argonaute и РНК-зависимой РНК-полимеразы[51]. В действительности, делеции данных генов в делящихся дрожжах Schizosaccharomyces pombe нарушает метилирование гистонов и образование центромер[52], вызывает замедление или остановку анафазы в процессе деления клетки[53]. В некоторых случаях подобные процессы связаны с модификацией гистонов и для них показан эффект повышения транскрипции соответствующих генов[54].
Механизм, по которому комплекс RITS вызывает образование гетерохроматина, изучен не полностью. Значительная часть исследований направлена на изучение участка генома дрожжей, регулирующего тип спаривания (англ. mating-type region), однако данный участок может быть нерепрезентативным в случае геномов других организмов. Для сохранения существующих районов гетерохроматина RITS образует комплексы с малыми интерферирующими РНК, комплементарными соответствующим генам и прочно связывается с метилированными гистонами. Далее RITS действует в момент транскрипции, деградируя любые пре-мРНК, синтезируемые РНК-полимеразой. Для образования подобных участков гетерохроматина требуется фермент Dicer, который синтезирует первичные комплементарные siRNA, участвующие в деградации транскриптов[55]. Поддержание участков хромосом в состоянии гетерохроматина, по-видимому, является примером положительной обратной связи, так как малые интерферирующие РНК, входящие в состав RITS, образуются из случайных транскриптов, синтезированных РНК-зависимой РНК-полимеразой[56]. Данные, полученные при исследовании центромерных районов хромосом дрожжей, вероятно, не могут быть распространены на млекопитающих, так как у последних поддержание гетерохроматиновых участков не всегда зависит от системы РНК-интерференции[57].
Связь с редактированием РНК
Наиболее распространённой формой редактирования РНК у высших эукариот является превращение аденозина в инозин в двуцепочечных РНК, которое осуществляется ферментом аденозиндеаминазой[58]. В 2000 году было предположено что путь РНК-интерференции и путь редактирования РНК A→I могут конкурировать за общий субстрат двуцепочечной РНК[59]. Действительно, некоторые предшественники малых интерферирующих РНК могут подвергаться редактированию A→I[60][61], причём данный механизм может регулировать процессинг и экспрессию зрелых молекул малых интерферирующих РНК[61] У млекопитающих описан как минимум один фермент, выводящий молекулы малых интерферирующих РНК из системы РНК-интерференции.[62]. Исследования линий круглого червя Caenorhabditis elegans, не имеющих фермента редактирования РНК A→I, показали, что редактирование РНК может препятствовать сайленсингу эндогенных генов и трансгенов по пути РНК-интерференции[63].
Различия между организмами

Организмы отличаются по способности воспринимать чужеродные двуцепочечные РНК и использовать их в процессе РНК-интерференции. Эффекты РНК-интерференции у растений и Caenorhabditis elegans (но не у дрозофилы и млекопитающих) могут наследоваться, а могут быть системными. У растений система РНК-интерференции может распространять малые интерферирующие РНК по плазмодесмам (каналам в клеточных стенках, осуществляющих коммуникацию и транспорт)[23]. Наследование обеспечивается метилированием промоторов, изменённый паттерн метилирования передаётся в результате деления дочерним клеткам[65]. Значительные отличия в мишенях малых интерферирующих РНК между растениями и животными обусловлены тем, что у растений микроРНК высоко комплементарны рибонуклеиновым мишеням и вызывают деградацию мРНК в составе RISC, а у животных малые интерферирующие РНК сильно отличаются по последовательности нуклеотидов и вызывают репрессию трансляции[64]. МикроРНК могут оказывать влияние на инициацию трансляции путём взаимодействия с факторами инициации трансляции и с поли(А)-трактом мРНК[66].
Некоторые простейшие, например, Leishmania major и Trypanosoma cruzi, не имеют никаких компонентов пути РНК-интерференции[67][68]. Большая часть компонентов системы РНК-интерференции также отсутствует у некоторых грибов, например, у модельного организма Saccharomyces cerevisiae[69]. Показано наличие компонентов системы РНК-интерференции в других делящихся дрожжах, например, Saccharomyces castellii и Candida albicans. Индукция двух белков системы РНК-интерференции из Saccharomyces castellii облегчает данный процесс у Saccharomyces cerevisiae[70]. Тот факт, что некоторые аскомицеты и базидиомицеты не имеют пути РНК-интерференции, указывает на то, что гены, кодирующие белки, необходимые для данного процесса, были утеряны независимо во многих родословных грибов, вероятно, по причине появления в ходе эволюции нового пути со сходными функциями, или ввиду утери адаптивного преимущества в данных экологических нишах[71].
Аналоги RNAi у прокариот
Экспрессия генов у прокариот регулируется системой, основанной на РНК, сходной по некоторым параметрам с системой РНК-интерференции. У прокариот описаны гены, кодирующие специальные РНК, которые контролируют распространение и трансляцию мРНК, путём спаривания с комплементарными последовательностями. Однако, данные регуляторные РНК не являются полными аналогами малым интерферирующим РНК, так как в данный процесс не вовлекается фермент Dicer[72]. Показано, что у прокариот система коротких палиндромных повторов, регулярно расположенных группами (CRISPR) является аналогичной системе РНК-интерференции у эукариот, хотя ни для одного из компонентов прокариотической системы не известны гомологичные эукариотические белки[73].
Биологические функции
Иммунитет
Система РНК-интерференции является важной частью иммунного ответа к вирусам и к другому чужеродному генетическому материалу. У растений система РНК-интерференции предотвращает распространение транспозонов[74]. Растения имеют несколько гомологов белка Dicer, которые направлены против различных типов вирусов[75]. Показано, что индуцированный сайленсинг генов у растений может передаваться от подвоя к прививаемому растению[76]. Эта особенность адаптивной иммунной системы растений позволяет после первоначального локального проникновения вируса отвечать на повторные проникновения вируса всему организму[77]. В ответ многие вирусы в ходе эволюции приобрели механизмы, подавляющие систему РНК-интерференции в клетках растений[78]. Описаны вирусные белки, связывающие короткие двуцепочечные фрагменты РНК с одноцепочечными выступами, образующиеся в результате активности белка Dicer[79]. Некоторые растения экспрессируют эндогенные малые интерферирующие РНК в ответ на заражение некоторыми бактериями[80]. Эти эффекты могут быть частью общего ответа на патогены, в результате которого в организме хозяина снижаются многие метаболические процессы в ответ на инфекцию[81].
Хотя в клетках животных, как правило, экспрессируется меньшее количество вариантов фермента Dicer, чем у растений, система РНК-интерференции у животных в некоторых случаях участвует в антивирусном ответе. РНК-интерференция у ювенильных и взрослых особей Drosophila играет важную роль во врождённом противовирусном иммунитете и принимает участие в защите против таких патогенов, как X-вирус Дрозофилы[англ.][82][83]. Сходную роль в иммунитете играет система РНК-интерференции у Caenorhabditis elegans: экспрессия белков Argonaute повышается при вирусной инфекции, при этом черви, в организме которых повышается экспрессия генов пути РНК-интерференции, приобретают устойчивость к вирусной инфекции[84][85].
Роль системы РНК-интерференции во врождённом иммунитете млекопитающих изучена не полностью. Однако тот факт, что некоторые вирусы содержат гены, снижающие ответ системы РНК-интерференции в клетках млекопитающих, свидетельствуют о наличии иммунного ответа, вызванного системой РНК-интерференции[86][87]. Однако, гипотеза иммунитета, опосредованного системой РНК-интерференции у млекопитающих, является недостаточно обоснованной[88]. Хотя недавно Майяр и соавт.[89] и Ли и соавт.[90] представили новые свидетельства существования в клетках млекопитающих функционального противовирусного пути РНК-интерференции. Малые интерферирующие РНК, экспрессируемые вирусом герпеса, могут вызывать образование гетерохроматина и приводить к переходу вируса в латентное состояние[91].
Показано, что удаление одной копии гена Dicer1 у мышей приводило к появлению большего количество опухолей, чем в контрольной группе, также понижались уровни микроРНК и выживаемость. Полное удаление гена Dicer1 блокировало образование опухолей, вероятно, также и потому, что некоторый уровень экспрессии продукта гена Dicer1 требуется для роста клеток[92].
В работах 2013 года показано, что в клетках млекопитающих имеется система РНК-интерференции, проявляющая противовирусную активность.[93][94] Другие функции системы РНК-интерференции вирусов млекопитающих представлены микроРНК вируса простого герпеса, которые действуют как организаторы гетерохроматина и приводят к латентности вируса.[95]
Экспрессия генов
При репрессии трансляции[64], на некоторых этапах развития живых организмов, особенно на стадии морфогенеза и поддержания клеток в недифференцированном состоянии (например, в случае стволовых клеток), важное значение имеют эндогенно экспрессируемые микроРНК, которые являются продуктами интронных и межгенных участков[96]. Роль таких эндогенно экспрессируемых микроРНК в подавлении экспрессии генов была впервые описана у нематоды Caenorhabditis elegans в 1993 году[97]. У растений такая функция микроРНК была впервые описана на модельном объекте Arabidopsis thaliana, для которого было показано влияние "JAW микроРНК" на регуляцию нескольких генов, контролирующих внешний вид[98]. У растений гены, регулируемые микроРНК, как правило, являются факторами транскрипции[99], поэтому микроРНК регулируют целые генные сети, изменяя экспрессию ключевых генов (в том числе, факторов транскрипции и белков F-box) в ходе эмбрионального развития[100]. У многих организмов, в том числе и у человека, микроРНК принимают участие в образовании опухолей и нарушении регуляции клеточного цикла. В данном случае микроРНК могут являться как онкогенами, так и супрессорами опухолей[101].
Последовательности малых интерферирующих РНК и микроРНК комплементарны последовательностям нуклеотидов промоторных участков. Связывание siRNA и микроРНК с этими участками может приводить к повышению транскрипции генов и активации РНК. Увеличение экспрессии данных генов происходит при участии белков Dicer и Argonaute, также происходит деметилирование гистонов[102][103].
Эволюция
Методы вычислительного филогенетического анализа свидетельствуют о том, что наиболее поздний общий предок всех эукариот имел РНК-интерференцию, отсутствие же системы РНК-интерференции у некоторых эукариот является приобретённым признаком[104]. Эволюционно древний путь РНК-интерференции, по-видимому, содержал ферменты, аналогичные Dicer, Argonaute, PIWI, а также РНК-зависимую РНК-полимеразу. Вероятно, наряду с РНК-интерференцией, эти ферменты играли в клетке и другие роли. Масштабные исследования в области сравнительной геномики свидетельствуют о том, что малая группа, ставшая родоначальником всех эукариот также имела компоненты, тесно связанные с системами деградации ДНК, например, сходные с экзосомными комплексами[105]. Семейство белков Argonaute, общее для многих эукариот, а также архей и некоторых бактерий (например, Aquifex aeolicus), гомологично и эволюционно происходит от компонентов системы инициации трансляции[105].
Наиболее древней функцией системы РНК-интерференции, как правило, называют защиту от экзогенных генетических элементов — геномов вирусов и транспозонов[104][106]. Некоторые связанные функции, например, модификация гистонов, могли быть представлены у предков современных эукариот, в то время как другие — например, регуляция развития при помощи микроРНК, по-видимому, появились позже[104].
Гены системы РНК-интерференции у многих эукариот являются компонентами врождённой иммунной системы, противостоящей вирусам. Некоторые вирусы растений приобрели механизмы подавления ответа системы РНК-интерференции клетки хозяина[78]. Скорость изменения генов пути РНК-интерференции у Drosophila направляется положительным отбором. Гены системы РНК-интерференции эволюционируют с очень высокой скоростью в сравнении с другими генами генома дрозофилы[107].
Применение

Выключение генов
Система РНК-интерференции часто используется в экспериментальной биологии для изучения функции генов в культурах клеток и в модельных организмах in vivo[1]. Синтетическую двуцепочечную РНК, комплементарную заданному гену, вводят в клетку или организм, где чужеродная молекула РНК запускает систему РНК-интерференции. Этот метод позволяет исследователям значительно снижать уровень экспрессии соответствующего гена. Изучение последствий снижения экспрессии интересующего гена позволяет выяснить физиологическую роль продукта данного гена-мишени. Так как система РНК-интерференции не может полностью выключить экспрессию гена, данный метод называется «нокдауном гена» — в отличие от полного удаления гена, «нокаута гена»[108].
Значительные достижения в области вычислительной биологии позволяют разрабатывать двуцепочечные РНК, которые обеспечивают максимальное снижение экспрессии гена-мишени и обладают минимальными побочными эффектами. Побочные эффекты могут возникать в случае, когда вводимая молекула РНК имеет последовательность, комплементарную нескольким генам одновременно, что приводит к снижению экспрессии нескольких генов на недостаточную величину. Подобные трудности возникают часто в случае, когда двуцепочечная РНК содержит повторяющиеся последовательности. Изучение геномов Homo sapiens, Caenorhabditis elegans, и Schizosaccharomyces pombe показало, что около 10 % молекул малых интерферирующих РНК будут приводить к значительным побочным эффектам[42] Разработано значительное количество компьютерных программ для подбора последовательностей малых интерферирующих РНК[109][110], в том числе, специфичных для млекопитающих[111] и вирусов[112]. Предлагаемые последовательности siRNA автоматически проверяются на перекрёстную активность.
В зависимости от организма и экспериментальной системы, экзогенные РНК могут быть сконструированы длинными и являться мишенью белка Dicer, либо короткими и являться субстратами малых интерферирующих РНК. Для большинства клеток млекопитающих предпочтительнее использовать более короткие РНК, так как длинные двуцепочечные РНК у млекопитающих вызывают интерфероновый ответ, форму врождённого иммунитета, неспецифической реакции на чужеродный генетический материал[113]. Для ооцитов мыши, а также для клеток эмбрионов мыши на ранних стадиях развития интерфероновый ответ на экзогенные двуцепочечные РНК не характерен, поэтому эти клетки являются удобной системой изучения нокдауна генов у млекопитающих[114]. Для использования системы РНК-интерференции в лабораторных условиях были разработаны специальные методы, не требующие прямого введения малых интерферирующих РНК в клетку, например, системы трансфекции плазмидой, кодирующие транскрибируемые последовательности siRNA[115], лентивирусные векторы, позволяющие индуцировать или инактивировать транскрипцию, называемые также англ. conditional RNAi[116][117].
Стратегию искусственной регуляции генов альтернативную РНК-интерференции обеспечивает метод CRISPRi действующий на уровне включения/выключения транскрипции[118]
Функциональная геномика

Методы функциональной геномики, использующие систему РНК-интерференции применяют обычно на Caenorhabditis elegans[120] и Drosophila melanogaster[121], так как данные животные являются наиболее часто используемыми моделями и система RNAi в этих организмах работает наиболее эффективно. Caenorhabditis elegans является удобным объектом для исследований при помощи РНК-интерференции по двум причинам — во-первых, эффекты сайленсинга генов у нематоды наследуются, и, во-вторых, потому что доставка двуцепочечной ДНК в нематоду чрезвычайно проста. Нематодам можно скармливать клетки бактерий, например, Escherichia coli, содержащие требуемые двуцепочечные РНК, которые при этом усваиваются через кишечник. Данный способ доставки РНК с пищей является эффективным с точки зрения эффективности сайленсинга генов и одновременно намного более дешёвым, простым и быстрым, чем обмакивание червей в раствор, содержащий двуцепочечные РНК или введение двуцепочечных РНК в гонады[122]. У большинства других организмов доставка двуцепочечных РНК представляется намного более трудоёмкой, однако принимаются попытки крупномасштабного исследования геномов в культурах клеток млекопитающих[123].
Подходы к созданию библиотек РНК-интерференции для полных геномов намного сложнее, чем в случае определённого набора малых интерферирующих РНК для заданного эксперимента. Для создания библиотек siRNA, а также прогнозирования их эффективности для нокдауна генов, часто применяют искусственные нейронные сети[124][125]. Массовые скрининги геномов являются многообещающими методиками для аннотации геномов, что привело к развитию методов высокопроизводительного скринирования на основе технологии ДНК-микрочипов[126][127]. Под вопросом остаётся возможность использования данных методик для исследования других организмов, — например, паразитических круглых червей[128][129].
Исследования в области функциональной геномики с использованием методов РНК-интерференции, являются привлекательными для картирования геномов и аннотации генов у растений, так как многие растения являются полиплоидами, что затрудняет исследования при помощи традиционных методов генетической инженерии. Например, РНК-интерференция успешно используется в функциональной геномике для изучения Triticum aestivum (гексаплоид)[130], а также и в случае других модельных растений — Arabidopsis thaliana и кукурузы[131].
Медицина
Возможно применение методов РНК-интерференции в терапии, в частности в РНК-терапии. Хотя введение длинных двуцепочечных РНК в клетки млекопитающих затруднено из-за интерферонового ответа, успешно используются молекулы, подобные малым интерферирующим РНК[132]. Были произведены клинические испытания терапии деградации сетчатки и лечения респираторного синцитиального вируса при помощи РНК-интерференции[133], также была показана эффективность системы RNAi для терапии повреждений печени на лабораторных мышах[134].
Другим возможным клиническим применением РНК-интерференции является лечение вируса простого герпеса типа 2 (например, в Harvard University Medical School) и ингибирование экспрессии генов вирусов в опухолевых клетках[135], нокдаун рецепторов хозяина к ВИЧ и корецепторов[136], сайленсинг генов гепатита A[137] и гепатита B[138], сайленсинг генов вируса гриппа[139], ингибирование репликации вируса кори[140]. Также возможно лечение нейродегенеративных заболеваний, например, болезни Хантингтона[141]. РНК-интерференцию также часто считают многообещающим способом лечения опухолей путём выключения генов, повышенно экспрессирующихся в клетках опухолей, либо генов, принимающих участие в делении клетки[142][143]. Важной областью исследований в области РНК-интерференции для клинического применения является разработка методов безопасной доставки малых РНК, например, подбор векторных систем, для терапии генами[144][145].
Несмотря на то, что появляются новые исследования на культурах клеток, подтверждающие потенциальную возможность терапии лекарствами на основе компонентов системы РНК-интерференции, остаются нерешёнными вопросы относительно безопасности таких методов лечения, в том числе, неочевидны последствия от побочных эффектов репрессии генов со сходными нуклеотидным последовательностями[146]. Методы вычислительной геномики показывают, что подобные побочные эффекты ошибочного связывания составляют до 10%[42]. Одно из крупных исследований заболеваний печени на мышах, показало более высокий уровень смертности среди экспериментальных животных, что было объяснено исследователями «перегрузкой» двуцепочечными РНК (miRNA, shRNA)[147], так как малые РНК, содержащие шпильку процессируются в ядре и экспортируются в цитоплазму по механизму активного транспорта. Все рассмотренные факты исследуются и в настоящее время, что ограничивает потенциальные приложения методов РНК-интерференции для терапии.
Кроме того существенным препятствием в развитии методов терапии с помощью РНК-интерференции является то, что доставка малых интерферирующих (миРНК) пока крайне неэффективна, и чрезвычайно высокие дозы препарата необходимы для достижения даже минимально значимого нокдауна гена-мишени. Однако разработанные в последнее время технологии позволяют надеяться, что в скором времени этот способ терапии все же войдёт и в клиническую практику. Так, например, обнаружено, что одновременная инъекция миРНК связанной с холестерином (chol-siRNA) и, обладающего эндосомолитическими свойствами, полимера ARC-520 позволила добиться более чем более 500-кратного повышения эффективности и достигнуть 90% снижения экспрессии гена-мишени у мышей in vivo.[148].
Разрабатываются способы использования РНК-интерференции для лечения персистирующей ВИЧ-инфекции первого типа. Вирусы, подобные ВИЧ-1 представляют собой сложную мишень для системы RNAi, так как требуют сочетания нескольких путей РНК-интерференции. Возможные способы антивирусной терапии при помощи системы РНК-интерференции представляются многообещающими, но крайне важным представляется также постановка многих контрольных экспериментов в доклинических испытаниях для того, чтобы однозначно показать сиквенс-специфичное действие системы RNAi[149].
Биотехнология
РНК-интерференция используется в биотехнологии, в частности для создания растений, синтезирующих натуральные токсичные вещества в более низких количествах. Разработаны методы создания растений, стабильно экспрессирующих компоненты системы РНК-интерференции, например, семена хлопка в норме богаты белком, пригодным для употребления в пищу, но содержат токсичный терпеноид госсипол (англ. gossypol). Методы, использующие явление РНК-интерференции, позволяют создавать линии хлопка с пониженным уровнем ключевого для синтеза госсипола фермента — (+)-δ-кадинен-синтазы. При этом, другие части растения экспрессируют данный фермент на обычном уровне, так как госсипол является важным соединением, защищающим растения от вредителей[150]. Сходные попытки принимаются для снижения уровня цианидов в натуральном продукте линамарине, получаемого из маниока (Manihot esculenta)[151].
Разработаны способы снижения уровней аллергенов в растениях томата[152] и способы снижения предшественников канцерогенов в растениях табака[153]. Другими примерами генно-инженерных изменений растений, является создание опийного мака со сниженным уровнем наркотических веществ[154], повышение устойчивости растений к вирусам[155], а также добавление в плоды томатов антиоксидантов[156]. Более ранние коммерческие генно-инженерные растения — томат и папайя, были разработаны с использованием антисмысловых РНК, по-видимому, работающих по механизму РНК-интерференции[157][158]. С помощью РНК-интерференции учёными Узбекистана была подавлена функция гена фитохрома А хлопчатника. В результате были получены линии хлопчатника у которых одновременно улучшены несколько важных признаков: длина и качество волокна,урожайность, время созревания, устойчивость к водному дефициту и солевому стрессу. На основе полученных линий хлопчатника были созданы новые высококачественные сорта хлопчатника серии Порлок, которые в настоящее время высеваются на полях Узбекистана. Волокно данных сортов реализуются по цене выше чем у обычного хлопчатника, так как по качественным характеристикам они превосходят волокна обычного хлопчатника[159].
Примечания
- ↑ 1 2 3 4 5 Daneholt, Bertil Advanced Information: RNA interference. The Nobel Prize in Physiology or Medicine 2006. Дата обращения: 25 января 2007. Архивировано 25 августа 2011 года.
- ↑ 1 2 Fire A., Xu S., Montgomery M., Kostas S., Driver S., Mello C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans (англ.) // Nature : journal. — 1998. — Vol. 391, no. 6669. — P. 806—811. — doi:10.1038/35888. — PMID 9486653.
- ↑ Matzke M. A., Matzke AJM. Planting the Seeds of a New Paradigm (англ.) // PLoS Biol : journal. — 2004. — Vol. 2, no. 5. — P. e133. — doi:10.1371/journal.pbio.0020133. — PMID 15138502.
- ↑ Ecker J. R., Davis R. W. Inhibition of gene expression in plant cells by expression of antisense RNA (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1986. — Vol. 83, no. 15. — P. 5372—5376. — doi:10.1073/pnas.83.15.5372. — PMID 16593734.
- ↑ Napoli C., Lemieux C., Jorgensen R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans (англ.) // Plant Cell : journal. — 1990. — Vol. 2, no. 4. — P. 279—289. — doi:10.1105/tpc.2.4.279. — PMID 12354959.
- ↑ Источник. Архивировано 29 апреля 2010 года.
- ↑ Romano N., Macino G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences (англ.) // Microbiology[англ.] : journal. — Microbiology Society[англ.], 1992. — Vol. 6, no. 22. — P. 3343—3353. — doi:10.1111/j.1365-2958.1992.tb02202.x. — PMID 1484489.
- ↑ Van Blokland R., Van der Geest N., Mol JNM, Kooter J. M. [www.blackwell-synergy.com/links/doi/10.1046/j.1365-313X.1994.6060861.x/abs/ Transgene-mediated suppression of chalcone synthase expression in Petunia hybrida results from an increase in RNA turnover] (англ.) // Plant J[англ.] : journal. — 1994. — Vol. 6. — P. 861—877. — doi:10.1046/j.1365-313X.1994.6060861.x/abs/. (недоступная ссылка)
- ↑ Mol JNM, van der Krol A. R. Antisense nucleic acids and proteins: fundamentals and applications (неопр.). — M. Dekker[англ.], 1991. — С. 4, 136. — ISBN 0824785169.
- ↑ Covey S., Al-Kaff N., Lángara A., Turner D. Plants combat infection by gene silencing (англ.) // Nature. — 1997. — Vol. 385. — P. 781—782. — doi:10.1038/385781a0.
- ↑ Ratcliff F., Harrison B., Baulcombe D. A Similarity Between Viral Defense and Gene Silencing in Plants (англ.) // Science : journal. — 1997. — Vol. 276. — P. 1558—1560. — doi:10.1126/science.276.5318.1558.
- ↑ Guo S., Kemphues K. par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed (англ.) // Cell : journal. — Cell Press, 1995. — Vol. 81, no. 4. — P. 611—620. — doi:10.1016/0092-8674(95)90082-9. — PMID 7758115.
- ↑ Pal-Bhadra M., Bhadra U., Birchler J. Cosuppression in Drosophila: gene silencing of Alcohol dehydrogenase by white-Adh transgenes is Polycomb dependent (англ.) // Cell : journal. — Cell Press, 1997. — Vol. 90, no. 3. — P. 479—490. — doi:10.1016/S0092-8674(00)80508-5. — PMID 9267028.
- ↑ 1 2 Bernstein E., Caudy A., Hammond S., Hannon G. Role for a bidentate ribonuclease in the initiation step of RNA interference (англ.) // Nature : journal. — 2001. — Vol. 409, no. 6818. — P. 363—366. — doi:10.1038/35053110. — PMID 11201747.
- ↑ Pillai R. S., Bhattacharyya S. N., Filipowicz W. Repression of protein synthesis by miRNAs: how many mechanisms? (англ.) // Trends Cell Biol[англ.] : journal. — PMID 17197185.
- ↑ Lee Y., Nakahara K., Pham J., Kim K., He Z., Sontheimer E., Carthew R. Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways (англ.) // Cell : journal. — Cell Press, 2004. — Vol. 117, no. 1. — P. 69—81. — doi:10.1016/S0092-8674(04)00261-2. — PMID 15066283.
- ↑ Gregory R., Chendrimada T., Shiekhattar R. MicroRNA biogenesis: isolation and characterization of the microprocessor complex (англ.) // Methods Mol Biol[англ.] : journal. — 2006. — Vol. 342. — P. 33—47. — PMID 16957365.
- ↑ Wang Q. L., Li Z. H. The functions of microRNAs in plants (англ.) // Frontiers in Bioscience[англ.] : journal. — Frontiers in Bioscience[англ.], 2007. — Vol. 12. — P. 3975—3982. — PMID 17485351.
- ↑ Zhao Y., Srivastava D. A developmental view of microRNA function (англ.) // Trends Biochem. Sci.[англ.] : journal. — 2007. — Vol. 32, no. 4. — P. 189—197. — doi:10.1016/j.tibs.2007.02.006. — PMID 17350266.
- ↑ Cifuentes D, Xue H, Taylor DW, Patnode H, Mishima Y, Cheloufi S, Ma E, Mane S, Hannon GJ, Lawson N, Wolfe S, Giraldez AJ. (2010) «A Novel miRNA Processing Pathway Independent of Dicer Requires Argonaute2 Catalytic Activity.» Science (Published Online May 6, 2010) doi:10.1126/science.1190809
- ↑ Cheloufi S, Dos Santos CO, Chong MM, Hannon GJ. A dicer-independent miRNA biogenesis pathway that requires Ago catalysis (англ.) // Nature. — 2010. — Iss. doi:10.1038/nature09092. — P. Published Online April 27, 2010.
- ↑ Gregory R., Chendrimada T., Cooch N., Shiekhattar R. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing (англ.) // Cell : journal. — Cell Press, 2005. — Vol. 123, no. 4. — P. 631—640. — doi:10.1016/j.cell.2005.10.022. — PMID 16271387.
- ↑ 1 2 Lodish H., Berk A., Matsudaira P., Kaiser C. A., Krieger M., Scott M. P., Zipurksy S. L., Darnell J. Molecular Cell Biology (неопр.). — 5th. — WH Freeman: New York, NY, 2004. — ISBN 978-0716743668. Архивировано 18 октября 2009 года.
- ↑ Matranga C., Tomari Y., Shin C., Bartel D., Zamore P. Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes (англ.) // Cell : journal. — Cell Press, 2005. — Vol. 123, no. 4. — P. 607—620. — doi:10.1016/j.cell.2005.08.044. — PMID 16271386.
- ↑ Leuschner P., Ameres S., Kueng S., Martinez J. Cleavage of the siRNA passenger strand during RISC assembly in human cells (англ.) // EMBO Rep[англ.] : journal. — 2006. — Vol. 7, no. 3. — P. 314—320. — doi:10.1038/sj.embor.7400637. — PMID 16439995.
- ↑ Schwarz D. S., Hutvágner G., Du T., Xu Z., Aronin N., Zamore P. D. Asymmetry in the assembly of the RNAi enzyme complex (англ.) // Cell : journal. — Cell Press, 2003. — Vol. 115, no. 2. — P. 199—208. — doi:10.1016/S0092-8674(03)00759-1. — PMID 14567917.
- ↑ Preall J., He Z., Gorra J., Sontheimer E. Short interfering RNA strand selection is independent of dsRNA processing polarity during RNAi in Drosophila (англ.) // Curr Biol : journal. — 2006. — Vol. 16, no. 5. — P. 530—535. — doi:10.1016/j.cub.2006.01.061. — PMID 16527750.
- ↑ Tomari Y., Matranga C., Haley B., Martinez N., Zamore P. A protein sensor for siRNA asymmetry (англ.) // Science. — 2004. — Vol. 306, no. 5700. — P. 1377—1380. — doi:10.1126/science.1102755. — PMID 15550672.
- ↑ Ma J., Yuan Y., Meister G., Pei Y., Tuschl T., Patel D. Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein (англ.) // Nature : journal. — 2005. — Vol. 434, no. 7033. — P. 666—670. — doi:10.1038/nature03514. — PMID 15800629.
- ↑ Sen G., Wehrman T., Blau H. mRNA translation is not a prerequisite for small interfering RNA-mediated mRNA cleavage (англ.) // Differentiation : journal. — 2005. — Vol. 73, no. 6. — P. 287—293. — doi:10.1111/j.1432-0436.2005.00029.x. — PMID 16138829.
- ↑ Gu S., Rossi J. Uncoupling of RNAi from active translation in mammalian cells (англ.) // RNA : journal. — 2005. — Vol. 11, no. 1. — P. 38—44. — doi:10.1261/rna.7158605. — PMID 15574516.
- ↑ Sen G., Blau H. Argonaute 2/RISC resides in sites of mammalian mRNA decay known as cytoplasmic bodies (англ.) // Nature Cell Biology : journal. — 2005. — Vol. 7, no. 6. — P. 633—636. — doi:10.1038/ncb1265. — PMID 15908945.
- ↑ Lian S., Jakymiw A., Eystathioy T., Hamel J., Fritzler M., Chan E. GW bodies, microRNAs and the cell cycle (англ.) // Cell Cycle[англ.] : journal. — 2006. — Vol. 5, no. 3. — P. 242—245. — PMID 16418578.
- ↑ Jakymiw A., Lian S., Eystathioy T., Li S., Satoh M., Hamel J., Fritzler M., Chan E. Disruption of P bodies impairs mammalian RNA interference (англ.) // Nature Cell Biology : journal. — 2005. — Vol. 7, no. 12. — P. 1267—1274. — doi:10.1038/ncb1334. — PMID 16284622.
- ↑ Hammond S., Bernstein E., Beach D., Hannon G. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells (англ.) // Nature : journal. — 2000. — Vol. 404, no. 6775. — P. 293—296. — doi:10.1038/35005107. — PMID 10749213.
- ↑ Bagasra O., Prilliman K. R. RNA interference: the molecular immune system (неопр.) // J. Mol. Histol.. — 2004. — Т. 35, № 6. — С. 545—553. — doi:10.1007/s10735-004-2192-8. — PMID 15614608. Архивировано 14 марта 2020 года.
- ↑ Macrae I., Zhou K., Li F., Repic A., Brooks A., Cande W., Adams P., Doudna J. Structural basis for double-stranded RNA processing by dicer (англ.) // Science : journal. — 2006. — Vol. 311, no. 5758. — P. 195—198. — doi:10.1126/science.1121638. — PMID 16410517.
- ↑ Siomi, Haruhiko; Siomi, Mikiko C. On the road to reading the RNA-interference code (англ.) // Nature : journal. — 2009. — 22 January (vol. 457, no. 7228). — P. 396—404. — doi:10.1038/nature07754. — PMID 19158785.
- ↑ Zamore P., Tuschl T., Sharp P., Bartel D. RNAi: double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals (англ.) // Cell : journal. — Cell Press, 2000. — Vol. 101, no. 1. — P. 25—33. — doi:10.1016/S0092-8674(00)80620-0. — PMID 10778853.
- ↑ Vermeulen A., Behlen L., Reynolds A., Wolfson A., Marshall W., Karpilow J., Khvorova A. The contributions of dsRNA structure to dicer specificity and efficiency (англ.) // RNA : journal. — 2005. — Vol. 11, no. 5. — P. 674—682. — doi:10.1261/rna.7272305. — PMID 15811921.
- ↑ Castanotto, Daniela; Rossi, John J. The promises and pitfalls of RNA-interference-based therapeutics (англ.) // Nature : journal. — 2009. — 22 January (vol. 457, no. 7228). — P. 426—433. — doi:10.1038/nature07758. — PMID 19158789.
- ↑ 1 2 3 Qiu S., Adema C., Lane T. A computational study of off-target effects of RNA interference (англ.) // Nucleic Acids Res : journal. — 2005. — Vol. 33, no. 6. — P. 1834—1847. — doi:10.1093/nar/gki324. — PMID 15800213.
- ↑ Ahlquist P. RNA-dependent RNA polymerases, viruses, and RNA silencing (англ.) // Science. — 2002. — Vol. 296, no. 5571. — P. 1270—1273. — doi:10.1126/science.1069132. — PMID 12016304.
- ↑ 1 2 Parker G., Eckert D., Bass B. RDE-4 preferentially binds long dsRNA and its dimerization is necessary for cleavage of dsRNA to siRNA (англ.) // RNA : journal. — 2006. — Vol. 12, no. 5. — P. 807—818. — doi:10.1261/rna.2338706. — PMID 16603715.
- ↑ Liu Q., Rand T., Kalidas S., Du F., Kim H., Smith D., Wang X. R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway (англ.) // Science : journal. — 2003. — Vol. 301, no. 5641. — P. 1921—1925. — doi:10.1126/science.1088710. — PMID 14512631.
- ↑ Baulcombe D. Molecular biology. Amplified silencing (англ.) // Science. — 2007. — Vol. 315, no. 5809. — P. 199—200. — doi:10.1126/science.1138030. — PMID 17218517.
- ↑ Pak J., Fire A. Distinct populations of primary and secondary effectors during RNAi in C. elegans (англ.) // Science : journal. — 2007. — Vol. 315, no. 5809. — P. 241—244. — doi:10.1126/science.1132839. — PMID 17124291.
- ↑ Sijen T., Steiner F., Thijssen K., Plasterk R. Secondary siRNAs result from unprimed RNA synthesis and form a distinct class (англ.) // Science : journal. — 2007. — Vol. 315, no. 5809. — P. 244—247. — doi:10.1126/science.1136699. — PMID 17158288.
- ↑ Holmquist G., Ashley T. Chromosome organization and chromatin modification: influence on genome function and evolution (англ.) // Cytogenetic and Genome Research[англ.] : journal. — Karger Publishers[англ.], 2006. — Vol. 114, no. 2. — P. 96—125. — doi:10.1159/000093326. — PMID 16825762.
- ↑ Verdel A., Jia S., Gerber S., Sugiyama T., Gygi S., Grewal S., Moazed D. RNAi-mediated targeting of heterochromatin by the RITS complex (англ.) // Science : journal. — 2004. — Vol. 303, no. 5658. — P. 672—676. — doi:10.1126/science.1093686. — PMID 14704433.
- ↑ Irvine D., Zaratiegui M., Tolia N., Goto D., Chitwood D., Vaughn M., Joshua-Tor L., Martienssen R. Argonaute slicing is required for heterochromatic silencing and spreading (англ.) // Science : journal. — 2006. — Vol. 313, no. 5790. — P. 1134—1137. — doi:10.1126/science.1128813. — PMID 16931764.
- ↑ Volpe T., Kidner C., Hall I., Teng G., Grewal S., Martienssen R. Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi (англ.) // Science : journal. — 2002. — Vol. 297, no. 5588. — P. 1833—1837. — doi:10.1126/science.1074973. — PMID 12193640.
- ↑ Volpe T., Schramke V., Hamilton G., White S., Teng G., Martienssen R., Allshire R. RNA interference is required for normal centromere function in fission yeast (англ.) // Chromosome Res : journal. — 2003. — Vol. 11, no. 2. — P. 137—146. — doi:10.1023/A:1022815931524. — PMID 12733640.
- ↑ Li LC, Okino ST, Zhao H, Pookot D, Place RF, Urakami S, Enokida H, Dahiya R. (2006). Small dsRNAs induce transcriptional activation in human cells. Proc Natl Acad Sci USA 103(46):17337–42. PMID 17085592
- ↑ Noma K., Sugiyama T., Cam H., Verdel A., Zofall M., Jia S., Moazed D., Grewal S. RITS acts in cis to promote RNA interference-mediated transcriptional and post-transcriptional silencing (англ.) // Nature Genetics : journal. — 2004. — Vol. 36, no. 11. — P. 1174—1180. — doi:10.1038/ng1452. — PMID 15475954.
- ↑ Sugiyama T., Cam H., Verdel A., Moazed D., Grewal S. RNA-dependent RNA polymerase is an essential component of a self-enforcing loop coupling heterochromatin assembly to siRNA production (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — Vol. 102, no. 1. — P. 152—157. — doi:10.1073/pnas.0407641102. — PMID 15615848.
- ↑ Wang F., Koyama N., Nishida H., Haraguchi T., Reith W., Tsukamoto T. The assembly and maintenance of heterochromatin initiated by transgene repeats are independent of the RNA interference pathway in mammalian cells (англ.) // Mol Cell Biol : journal. — 2006. — Vol. 26, no. 11. — P. 4028—4040. — doi:10.1128/MCB.02189-05. — PMID 16705157.
- ↑ Bass B. RNA editing by adenosine deaminases that act on RNA (англ.) // Annu Rev Biochem[англ.] : journal. — 2002. — Vol. 71. — P. 817—846. — doi:10.1146/annurev.biochem.71.110601.135501. — PMID 12045112.
- ↑ Bass B. Double-stranded RNA as a template for gene silencing (англ.) // Cell : journal. — Cell Press, 2000. — Vol. 101, no. 3. — P. 235—238. — doi:10.1016/S0092-8674(02)71133-1. — PMID 10847677.
- ↑ Luciano D., Mirsky H., Vendetti N., Maas S. RNA editing of a miRNA precursor (неопр.) // RNA. — 2004. — Т. 10, № 8. — С. 1174—1177. — doi:10.1261/rna.7350304. — PMID 15272117.
- ↑ 1 2 Yang W., Chendrimada T., Wang Q., Higuchi M., Seeburg P., Shiekhattar R., Nishikura K. Modulation of microRNA processing and expression through RNA editing by ADAR deaminases (англ.) // Nature Structural & Molecular Biology : journal. — 2006. — Vol. 13, no. 1. — P. 13—21. — doi:10.1038/nsmb1041. — PMID 16369484.
- ↑ Yang W., Wang Q., Howell K., Lee J., Cho D., Murray J., Nishikura K. ADAR1 RNA deaminase limits short interfering RNA efficacy in mammalian cells (англ.) // J Biol Chem : journal. — 2005. — Vol. 280, no. 5. — P. 3946—3953. — doi:10.1074/jbc.M407876200. — PMID 15556947.
- ↑ Nishikura K. Editor meets silencer: crosstalk between RNA editing and RNA interference (англ.) // Nature Reviews Molecular Cell Biology : journal. — 2006. — Vol. 7, no. 12. — P. 919—931. — doi:10.1038/nrm2061. — PMID 17139332.
- ↑ 1 2 3 Saumet A., Lecellier C. H. Anti-viral RNA silencing: do we look like plants? (англ.) // BioMed Central[англ.]. — 2006. — Vol. 3, no. 3. — P. 3. — doi:10.1186/1742-4690-3-3. — PMID 16409629.
- ↑ Jones L., Ratcliff F., Baulcombe D. C. RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance (англ.) // Current Biology : journal. — Cell Press, 2001. — Vol. 11, no. 10. — P. 747—757. — doi:10.1016/S0960-9822(01)00226-3. Архивировано 21 декабря 2007 года.
- ↑ Humphreys D. T., Westman B. J., Martin D. I., Preiss T. MicroRNAs control translation initiation by inhibiting eukaryotic initiation factor 4E/cap and poly(A) tail function (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — Vol. 102. — P. 16961—16966. — doi:10.1073/pnas.0506482102. — PMID 16287976.
- ↑ DaRocha W., Otsu K., Teixeira S., Donelson J. Tests of cytoplasmic RNA interference (RNAi) and construction of a tetracycline-inducible T7 promoter system in Trypanosoma cruzi (англ.) // Mol Biochem Parasitol : journal. — 2004. — Vol. 133, no. 2. — P. 175—186. — doi:10.1016/j.molbiopara.2003.10.005. — PMID 14698430.
- ↑ Robinson K., Beverley S. Improvements in transfection efficiency and tests of RNA interference (RNAi) approaches in the protozoan parasite Leishmania (англ.) // Mol Biochem Parasitol : journal. — 2003. — Vol. 128, no. 2. — P. 217—228. — doi:10.1016/S0166-6851(03)00079-3. — PMID 12742588.
- ↑ L. Aravind, Hidemi Watanabe, David J. Lipman, and Eugene V. Koonin. Lineage-specific loss and divergence of functionally linked genes in eukaryotes (англ.) // Proceedings of the National Academy of Sciences : journal. — 2000. — Vol. 97, no. 21. — P. 11319—11324. — doi:10.1073/pnas.200346997. — PMID 11016957.
- ↑ Drinnenberg I. A., Weinberg D. E., Xie K. T., Nower J. P., Wolfe K. H., Fink G. R., Bartel D. P. RNAi in Budding Yeast (англ.) // Science. — 2009. — doi:10.1126/science.1176945. — PMID 19745116.
- ↑ Nakayashiki H., Kadotani N., Mayama S. Evolution and diversification of RNA silencing proteins in fungi (англ.) // J Mol Evol[англ.] : journal. — 2006. — Vol. 63, no. 1. — P. 127—135. — doi:10.1007/s00239-005-0257-2. — PMID 16786437.
- ↑ Morita T., Mochizuki Y., Aiba H. Translational repression is sufficient for gene silencing by bacterial small noncoding RNAs in the absence of mRNA destruction (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — Vol. 103, no. 13. — P. 4858—4863. — doi:10.1073/pnas.0509638103. — PMID 16549791.
- ↑ Makarova K., Grishin N., Shabalina S., Wolf Y., Koonin E. A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action (англ.) // Biol Direct[англ.] : journal. — 2006. — Vol. 1. — P. 7. — doi:10.1186/1745-6150-1-7. — PMID 16545108.
- ↑ Stram Y., Kuzntzova L. Inhibition of viruses by RNA interference (неопр.) // Virus Genes. — 2006. — Т. 32, № 3. — С. 299—306. — doi:10.1007/s11262-005-6914-0. — PMID 16732482.
- ↑ Blevins T., Rajeswaran R., Shivaprasad P., Beknazariants D., Si-Ammour A., Park H., Vazquez F., Robertson D., Meins F., Hohn T., Pooggin M. Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing (англ.) // Nucleic Acids Res : journal. — 2006. — Vol. 34, no. 21. — P. 6233—6246. — doi:10.1093/nar/gkl886. — PMID 17090584.
- ↑ Palauqui J., Elmayan T., Pollien J., Vaucheret H. Systemic acquired silencing: transgene-specific post-transcriptional silencing is transmitted by grafting from silenced stocks to non-silenced scions (англ.) // EMBO J : journal. — 1997. — Vol. 16, no. 15. — P. 4738—4745. — doi:10.1093/emboj/16.15.4738. — PMID 9303318.
- ↑ Voinnet O. RNA silencing as a plant immune system against viruses (фр.) // Trends Genet[англ.] : magazine. — 2001. — Vol. 17, no 8. — P. 449—459. — doi:10.1016/S0168-9525(01)02367-8. — PMID 11485817.
- ↑ 1 2 Lucy A., Guo H., Li W., Ding S. Suppression of post-transcriptional gene silencing by a plant viral protein localized in the nucleus (англ.) // EMBO J : journal. — 2000. — Vol. 19, no. 7. — P. 1672—1680. — doi:10.1093/emboj/19.7.1672. — PMID 10747034.
- ↑ Mérai Z., Kerényi Z., Kertész S., Magna M., Lakatos L., Silhavy D. Double-stranded RNA binding may be a general plant RNA viral strategy to suppress RNA silencing (англ.) // J Virol[англ.] : journal. — 2006. — Vol. 80, no. 12. — P. 5747—5756. — doi:10.1128/JVI.01963-05. — PMID 16731914.
- ↑ Katiyar-Agarwal S., Morgan R., Dahlbeck D., Borsani O., Villegas A., Zhu J., Staskawicz B., Jin H. A pathogen-inducible endogenous siRNA in plant immunity (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — Vol. 103, no. 47. — P. 18002—18007. — doi:10.1073/pnas.0608258103. — PMID 17071740.
- ↑ Fritz J., Girardin S., Philpott D. Innate immune defense through RNA interference (англ.) // Sci STKE[англ.] : journal. — 2006. — Vol. 2006, no. 339. — P. pe27. — doi:10.1126/stke.3392006pe27. — PMID 16772641.
- ↑ Zambon R., Vakharia V., Wu L. RNAi is an antiviral immune response against a dsRNA virus in Drosophila melanogaster (неопр.) // Cell Microbiol. — 2006. — Т. 8, № 5. — С. 880—889. — doi:10.1111/j.1462-5822.2006.00688.x. — PMID 16611236.
- ↑ Wang X., Aliyari R., Li W., Li H., Kim K., Carthew R., Atkinson P., Ding S. RNA interference directs innate immunity against viruses in adult Drosophila (англ.) // Science : journal. — 2006. — Vol. 312, no. 5772. — P. 452—454. — doi:10.1126/science.1125694. — PMID 16556799.
- ↑ Lu R., Maduro M., Li F., Li H., Broitman-Maduro G., Li W., Ding S. Animal virus replication and RNAi-mediated antiviral silencing in Caenorhabditis elegans (англ.) // Nature : journal. — 2005. — Vol. 436, no. 7053. — P. 1040—1043. — doi:10.1038/nature03870. — PMID 16107851.
- ↑ Wilkins C., Dishongh R., Moore S., Whitt M., Chow M., Machaca K. RNA interference is an antiviral defence mechanism in Caenorhabditis elegans (англ.) // Nature : journal. — 2005. — Vol. 436, no. 7053. — P. 1044—1047. — doi:10.1038/nature03957. — PMID 16107852.
- ↑ Berkhout B., Haasnoot J. The interplay between virus infection and the cellular RNA interference machinery (англ.) // FEBS Lett[англ.] : journal. — 2006. — Vol. 580, no. 12. — P. 2896—2902. — doi:10.1016/j.febslet.2006.02.070. — PMID 16563388.
- ↑ Schütz S., Sarnow P. Interaction of viruses with the mammalian RNA interference pathway (англ.) // Virology : journal. — 2006. — Vol. 344, no. 1. — P. 151—157. — doi:10.1016/j.virol.2005.09.034. — PMID 16364746.
- ↑ Cullen B. Is RNA interference involved in intrinsic antiviral immunity in mammals? (англ.) // Nature Immunology : journal. — 2006. — Vol. 7, no. 6. — P. 563—567. — doi:10.1038/ni1352. — PMID 16715068.
- ↑ P. V. Maillard, C. Ciaudo, A. Marchais, Y. Li, F. Jay, S. W. Ding, and Olivier Voinnet (2013) Antiviral RNA Interference in Mammalian Cells. Science,342(6155), 235-238 DOI: 10.1126/science.1241930
- ↑ Yang Li, Jinfeng Lu, Yanhong Han, Xiaoxu Fan, and Shou-Wei Ding (2013) RNA Interference Functions as an Antiviral Immunity Mechanism in Mammals. Science,342(6155), 231-234 DOI: 10.1126/science.1241911
- ↑ Li H., Ding S. Antiviral silencing in animals (англ.) // FEBS Lett[англ.] : journal. — 2005. — Vol. 579, no. 26. — P. 5965—5973. — doi:10.1016/j.febslet.2005.08.034. — PMID 16154568.
- ↑ Madhu S. Kumar, Ryan E. Pester, Cindy Y. Chen, Keara Lane, Christine Chin, Jun Lu, David G. Kirsch, Todd R. Golub, Tyler Jacks. Dicer1 functions as a haploinsufficient tumor suppressor // Genes & Dev. — 2009. — Т. 23. — С. 2700—2704. Архивировано 14 мая 2016 года.
- ↑ P. V. Maillard, C. Ciaudo, A. Marchais, Y. Li, F. Jay, S. W. Ding, and Olivier Voinnet (2013) Antiviral RNA Interference in Mammalian Cells. Science , 342(6155), 235—238 doi:10.1126/science.1241930
- ↑ Yang Li, Jinfeng Lu, Yanhong Han, Xiaoxu Fan, and Shou-Wei Ding (2013) RNA Interference Functions as an Antiviral Immunity Mechanism in Mammals" Science342(6155), 231—234 doi:10.1126/science.1241911
- ↑ Li H., Ding S. Antiviral silencing in animals (англ.) // FEBS Lett[англ.] : journal. — 2005. — Vol. 579, no. 26. — P. 5965—5973. — doi:10.1016/j.febslet.2005.08.034. — PMID 16154568. — PMC 1350842.
- ↑ Carrington J., Ambros V. Role of microRNAs in plant and animal development (англ.) // Science. — 2003. — Vol. 301, no. 5631. — P. 336—338. — doi:10.1126/science.1085242. — PMID 12869753.
- ↑ Lee R., Feinbaum R., Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14 (англ.) // Cell : journal. — Cell Press, 1993. — Vol. 75, no. 5. — P. 843—854. — doi:10.1016/0092-8674(93)90529-Y. — PMID 8252621.
- ↑ Palatnik J., Allen E., Wu X., Schommer C., Schwab R., Carrington J., Weigel D. Control of leaf morphogenesis by microRNAs (англ.) // Nature. — 2003. — Vol. 425, no. 6955. — P. 257—263. — doi:10.1038/nature01958. — PMID 12931144.
- ↑ Zhang B., Pan X., Cobb G., Anderson T. Plant microRNA: a small regulatory molecule with big impact (англ.) // Dev Biol[англ.] : journal. — 2006. — Vol. 289, no. 1. — P. 3—16. — doi:10.1016/j.ydbio.2005.10.036. — PMID 16325172.
- ↑ Jones-Rhoades M., Bartel D., Bartel B. MicroRNAS and their regulatory roles in plants (англ.) // Annu Rev Plant Biol : journal. — 2006. — Vol. 57. — P. 19—53. — doi:10.1146/annurev.arplant.57.032905.105218. — PMID 16669754.
- ↑ Zhang B., Pan X., Cobb G., Anderson T. microRNAs as oncogenes and tumor suppressors (англ.) // Dev Biol[англ.] : journal. — 2007. — Vol. 302, no. 1. — P. 1—12. — doi:10.1016/j.ydbio.2006.08.028. — PMID 16989803.
- ↑ Check E. RNA interference: hitting the on switch (англ.) // Nature. — 2007. — Vol. 448, no. 7156. — P. 855—858. — doi:10.1038/448855a. — PMID 17713502.
- ↑ Li L. C., Okino S. T., Zhao H., et al. Small dsRNAs induce transcriptional activation in human cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — Vol. 103, no. 46. — P. 17337—17342. — doi:10.1073/pnas.0607015103. — PMID 17085592.
- ↑ 1 2 3 Cerutti H., Casas-Mollano J. On the origin and functions of RNA-mediated silencing: from protists to man (англ.) // Curr Genet : journal. — 2006. — Vol. 50, no. 2. — P. 81—99. — doi:10.1007/s00294-006-0078-x. — PMID 16691418.
- ↑ 1 2 Anantharaman V., Koonin E., Aravind L. Comparative genomics and evolution of proteins involved in RNA metabolism (англ.) // Nucleic Acids Res : journal. — 2002. — Vol. 30, no. 7. — P. 1427—1464. — doi:10.1093/nar/30.7.1427. — PMID 11917006.
- ↑ Buchon N., Vaury C. RNAi: a defensive RNA-silencing against viruses and transposable elements (фр.) // Heredity : magazine. — 2006. — Vol. 96, no 2. — P. 195—202. — doi:10.1038/sj.hdy.6800789. — PMID 16369574.
- ↑ Obbard D., Jiggins F., Halligan D., Little T. Natural selection drives extremely rapid evolution in antiviral RNAi genes (англ.) // Curr Biol : journal. — 2006. — Vol. 16, no. 6. — P. 580—585. — doi:10.1016/j.cub.2006.01.065. — PMID 16546082.
- ↑ Voorhoeve P. M., Agami R. Knockdown stands up (англ.) // Trends Biotechnol.[англ.] : journal. — 2003. — Vol. 21, no. 1. — P. 2—4. — doi:10.1016/S0167-7799(02)00002-1. — PMID 12480342. Архивировано 3 декабря 2019 года.
- ↑ Naito Y., Yamada T., Matsumiya T., Ui-Tei K., Saigo K., Morishita S. dsCheck: highly sensitive off-target search software for double-stranded RNA-mediated RNA interference (англ.) // Nucleic Acids Res : journal. — 2005. — Vol. 33, no. Web Server issue. — P. W589—91. — doi:10.1093/nar/gki419. — PMID 15980542.
- ↑ Henschel A., Buchholz F., Habermann B. DEQOR: a web-based tool for the design and quality control of siRNAs (англ.) // Nucleic Acids Res : journal. — 2004. — Vol. 32, no. Web Server issue. — P. W113—20. — doi:10.1093/nar/gkh408. — PMID 15215362.
- ↑ Naito Y., Yamada T., Ui-Tei K., Morishita S., Saigo K. siDirect: highly effective, target-specific siRNA design software for mammalian RNA interference (англ.) // Nucleic Acids Res : journal. — 2004. — Vol. 32, no. Web Server issue. — P. W124—9. — doi:10.1093/nar/gkh442. — PMID 15215364.
- ↑ Naito Y., Ui-Tei K., Nishikawa T., Takebe Y., Saigo K. siVirus: web-based antiviral siRNA design software for highly divergent viral sequences (англ.) // Nucleic Acids Res : journal. — 2006. — Vol. 34, no. Web Server issue. — P. W448—50. — doi:10.1093/nar/gkl214. — PMID 16845046.
- ↑ Reynolds A., Anderson E., Vermeulen A., Fedorov Y., Robinson K., Leake D., Karpilow J., Marshall W., Khvorova A. Induction of the interferon response by siRNA is cell type- and duplex length-dependent (англ.) // RNA : journal. — 2006. — Vol. 12, no. 6. — P. 988—993. — doi:10.1261/rna.2340906. — PMID 16611941.
- ↑ Stein P., Zeng F., Pan H., Schultz R. Absence of non-specific effects of RNA interference triggered by long double-stranded RNA in mouse oocytes (англ.) // Dev Biol[англ.] : journal. — 2005. — Vol. 286, no. 2. — P. 464—471. — doi:10.1016/j.ydbio.2005.08.015. — PMID 16154556.
- ↑ Brummelkamp T., Bernards R., Agami R. A system for stable expression of short interfering RNAs in mammalian cells (англ.) // Science : journal. — 2002. — Vol. 296, no. 5567. — P. 550—553. — doi:10.1126/science.1068999. — PMID 11910072.
- ↑ Tiscornia G., Tergaonkar V., Galimi F., Verma I. CRE recombinase-inducible RNA interference mediated by lentiviral vectors (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — Vol. 101, no. 19. — P. 7347—7351. — doi:10.1073/pnas.0402107101. — PMID 15123829.
- ↑ Ventura A., Meissner A., Dillon C., McManus M., Sharp P., Van Parijs L., Jaenisch R, Jacks T. Cre-lox-regulated conditional RNA interference from transgenes (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — Vol. 101, no. 28. — P. 10380—10385. — doi:10.1073/pnas.0403954101. — PMID 15240889.
- ↑ Gilbert, L. A., Larson, M. H., Morsut, L., et al. & Qi, L. S. (2013) CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes. Cell, 154(2), 442-451 doi: 10.1016/j.cell.2013.06.044
- ↑ Brock T., Browse J., Watts J. Genetic regulation of unsaturated fatty acid composition in C. elegans (англ.) // PLoS Genet[англ.] : journal. — 2006. — Vol. 2, no. 7. — P. e108. — doi:10.1371/journal.pgen.0020108. — PMID 16839188. Архивировано 22 февраля 2008 года.
- ↑ Kamath R., Ahringer J. Genome-wide RNAi screening in Caenorhabditis elegans (неопр.) // Methods. — 2003. — Т. 30, № 4. — С. 313—321. — doi:10.1016/S1046-2023(03)00050-1. — PMID 12828945.
- ↑ Boutros M., Kiger A., Armknecht S., Kerr K., Hild M., Koch B., Haas S., Paro R., Perrimon N. Genome-wide RNAi analysis of growth and viability in Drosophila cells (англ.) // Science : journal. — 2004. — Vol. 303, no. 5659. — P. 832—835. — doi:10.1126/science.1091266. — PMID 14764878.
- ↑ Fortunato A., Fraser A. Uncover genetic interactions in Caenorhabditis elegans by RNA interference (англ.) // Biosci Rep : journal. — 2005. — Vol. 25, no. 5—6. — P. 299—307. — doi:10.1007/s10540-005-2892-7. — PMID 16307378.
- ↑ Cullen L., Arndt G. Genome-wide screening for gene function using RNAi in mammalian cells (англ.) // Immunol Cell Biol[англ.] : journal. — 2005. — Vol. 83, no. 3. — P. 217—223. — doi:10.1111/j.1440-1711.2005.01332.x. — PMID 15877598.
- ↑ Huesken D., Lange J., Mickanin C., Weiler J., Asselbergs F., Warner J., Meloon B., Engel S., Rosenberg A., Cohen D., Labow M., Reinhardt M., Natt F., Hall J. Design of a genome-wide siRNA library using an artificial neural network (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2005. — Vol. 23, no. 8. — P. 995—1001. — doi:10.1038/nbt1118. — PMID 16025102.
- ↑ Ge G., Wong G., Luo B. Prediction of siRNA knockdown efficiency using artificial neural network models (англ.) // Biochem Biophys Res Commun[англ.] : journal. — 2005. — Vol. 336, no. 2. — P. 723—728. — doi:10.1016/j.bbrc.2005.08.147. — PMID 16153609.
- ↑ Janitz M., Vanhecke D., Lehrach H. High-throughput RNA interference in functional genomics (англ.) // Handb Exp Pharmacol : journal. — 2006. — Vol. 173. — P. 97—104. — doi:10.1007/3-540-27262-3_5. — PMID 16594612.
- ↑ Vanhecke D., Janitz M. Functional genomics using high-throughput RNA interference (англ.) // Drug Discov Today[англ.] : journal. — 2005. — Vol. 10, no. 3. — P. 205—212. — doi:10.1016/S1359-6446(04)03352-5. — PMID 15708535.
- ↑ Geldhof P., Murray L., Couthier A., Gilleard J., McLauchlan G., Knox D., Britton C. Testing the efficacy of RNA interference in Haemonchus contortus (англ.) // International Journal for Parasitology[англ.] : journal. — Elsevier, 2006. — Vol. 36, no. 7. — P. 801—810. — doi:10.1016/j.ijpara.2005.12.004. — PMID 16469321.
- ↑ Geldhof P., Visser A., Clark D., Saunders G., Britton C., Gilleard J., Berriman M., Knox D. RNA interference in parasitic helminths: current situation, potential pitfalls and future prospects (англ.) // Parasitology : journal. — 2007. — Vol. 134. — P. 1—11. — doi:10.1017/S0031182006002071. — PMID 17201997.
- ↑ Travella S., Klimm T., Keller B. RNA interference-based gene silencing as an efficient tool for functional genomics in hexaploid bread wheat (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2006. — Vol. 142, no. 1. — P. 6—20. — doi:10.1104/pp.106.084517. — PMID 16861570.
- ↑ McGinnis K., Chandler V., Cone K., Kaeppler H., Kaeppler S., Kerschen A., Pikaard C., Richards E., Sidorenko L., Smith T., Springer N., Wulan T. Transgene-induced RNA interference as a tool for plant functional genomics (англ.) // Methods Enzymol : journal. — 2005. — Vol. 392. — P. 1—24. — doi:10.1016/S0076-6879(04)92001-0. — PMID 15644172.
- ↑ Paddison P., Caudy A., Hannon G. Stable suppression of gene expression by RNAi in mammalian cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — Vol. 99, no. 3. — P. 1443—1448. — doi:10.1073/pnas.032652399. — PMID 11818553.
- ↑ Sah D. Therapeutic potential of RNA interference for neurological disorders (англ.) // Life Sci[англ.] : journal. — 2006. — Vol. 79, no. 19. — P. 1773—1780. — doi:10.1016/j.lfs.2006.06.011. — PMID 16815477.
- ↑ Zender L., Hutker S., Liedtke C., Tillmann H., Zender S., Mundt B., Waltemathe M., Gosling T., Flemming P., Malek N., Trautwein C., Manns M., Kuhnel F., Kubicka S. Caspase 8 small interfering RNA prevents acute liver failure in mice (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2003. — Vol. 100, no. 13. — P. 7797—7802. — doi:10.1073/pnas.1330920100. — PMID 12810955.
- ↑ Jiang M., Milner J. Selective silencing of viral gene expression in HPV-positive human cervical carcinoma cells treated with siRNA, a primer of RNA interference (англ.) // Oncogene : journal. — 2002. — Vol. 21, no. 39. — P. 6041—6048. — doi:10.1038/sj.onc.1205878. — PMID 12203116.
- ↑ Crowe S. Suppression of chemokine receptor expression by RNA interference allows for inhibition of HIV-1 replication, by Martínez et al (англ.) // AIDS : journal. — 2003. — Vol. 17 Suppl 4. — P. S103—5. — PMID 15080188. Архивировано 5 декабря 2019 года.
- ↑ Kusov Y., Kanda T., Palmenberg A., Sgro J., Gauss-Müller V. Silencing of hepatitis A virus infection by small interfering RNAs (англ.) // J Virol[англ.] : journal. — 2006. — Vol. 80, no. 11. — P. 5599—5610. — doi:10.1128/JVI.01773-05. — PMID 16699041.
- ↑ Jia F., Zhang Y., Liu C. A retrovirus-based system to stably silence hepatitis B virus genes by RNA interference (англ.) // Biotechnol Lett[англ.] : journal. — 2006. — Vol. 28, no. 20. — P. 1679—1685. — doi:10.1007/s10529-006-9138-z. — PMID 16900331.
- ↑ Li Y., Kong L., Cheng B., Li K. Construction of influenza virus siRNA expression vectors and their inhibitory effects on multiplication of influenza virus (англ.) // Avian Dis[англ.] : journal. — 2005. — Vol. 49, no. 4. — P. 562—573. — doi:10.1637/7365-041205R2.1. — PMID 16405000.
- ↑ Hu L., Wang Z., Hu C., Liu X., Yao L., Li W., Qi Y. Inhibition of Measles virus multiplication in cell culture by RNA interference (англ.) // Acta Virol : journal. — 2005. — Vol. 49, no. 4. — P. 227—234. — PMID 16402679.
- ↑ Raoul C., Barker S., Aebischer P. Viral-based modelling and correction of neurodegenerative diseases by RNA interference (англ.) // Gene Ther : journal. — 2006. — Vol. 13, no. 6. — P. 487—495. — doi:10.1038/sj.gt.3302690. — PMID 16319945.
- ↑ Putral L., Gu W., McMillan N. RNA interference for the treatment of cancer (неопр.) // Drug News Perspect. — 2006. — Т. 19, № 6. — С. 317—324. — doi:10.1358/dnp.2006.19.6.985937. — PMID 16971967.
- ↑ Izquierdo M. Short interfering RNAs as a tool for cancer gene therapy (англ.) // Cancer Gene Ther : journal. — 2005. — Vol. 12, no. 3. — P. 217—227. — doi:10.1038/sj.cgt.7700791. — PMID 15550938.
- ↑ Li C., Parker A., Menocal E., Xiang S., Borodyansky L., Fruehauf J. Delivery of RNA interference (англ.) // Cell Cycle[англ.] : journal. — 2006. — Vol. 5, no. 18. — P. 2103—2109. — PMID 16940756.
- ↑ Takeshita F., Ochiya T. Therapeutic potential of RNA interference against cancer (англ.) // Cancer Sci[англ.] : journal. — 2006. — Vol. 97, no. 8. — P. 689—696. — doi:10.1111/j.1349-7006.2006.00234.x. — PMID 16863503.
- ↑ Tong A., Zhang Y., Nemunaitis J. Small interfering RNA for experimental cancer therapy (англ.) // Current Opinion in Molecular Therapeutics : journal. — 2005. — Vol. 7, no. 2. — P. 114—124. — PMID 15844618.
- ↑ Grimm D., Streetz K., Jopling C., Storm T., Pandey K., Davis C., Marion P., Salazar F., Kay M. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways (англ.) // Nature : journal. — 2006. — Vol. 441, no. 7092. — P. 537—541. — doi:10.1038/nature04791. — PMID 16724069.
- ↑ So C. Wong, Jason J. Klein, Holly L. Hamilton et al. and David L. Lewis.(2012) Co-Injection of a Targeted, Reversibly Masked Endosomolytic Polymer Dramatically Improves the Efficacy of Cholesterol-Conjugated Small Interfering RNAs In Vivo. Nucleic Acid Therapeutics., 22(6): 380-390. doi:10.1089/nat.2012.0389
- ↑ Berkhout, B; ter Brake, O. RNAi Gene Therapy to Control HIV-1 Infection // RNA Interference and Viruses: Current Innovations and Future Trends (англ.). — Caister Academic Press[англ.], 2010. — ISBN 978-1-904455-56-1.
- ↑ Sunilkumar G., Campbell L., Puckhaber L., Stipanovic R., Rathore K. Engineering cottonseed for use in human nutrition by tissue-specific reduction of toxic gossypol (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — Vol. 103, no. 48. — P. 18054—18059. — doi:10.1073/pnas.0605389103. — PMID 17110445.
- ↑ Siritunga D., Sayre R. Generation of cyanogen-free transgenic cassava (неопр.) // Planta. — 2003. — Т. 217, № 3. — С. 367—373. — doi:10.1007/s00425-003-1005-8. — PMID 14520563.
- ↑ Le L., Lorenz Y., Scheurer S., Fötisch K., Enrique E., Bartra J., Biemelt S., Vieths S., Sonnewald U. Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression (англ.) // Plant Biotechnol J[англ.] : journal. — 2006. — Vol. 4, no. 2. — P. 231—242. — doi:10.1111/j.1467-7652.2005.00175.x. — PMID 17177799.
- ↑ Gavilano L., Coleman N., Burnley L., Bowman M., Kalengamaliro N., Hayes A., Bush L., Siminszky B. Genetic engineering of Nicotiana tabacum for reduced nornicotine content (англ.) // J Agric Food Chem[англ.] : journal. — 2006. — Vol. 54, no. 24. — P. 9071—9078. — doi:10.1021/jf0610458. — PMID 17117792.
- ↑ Allen R., Millgate A., Chitty J., Thisleton J., Miller J., Fist A., Gerlach W., Larkin P. RNAi-mediated replacement of morphine with the nonnarcotic alkaloid reticuline in opium poppy (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2004. — Vol. 22, no. 12. — P. 1559—1566. — doi:10.1038/nbt1033. — PMID 15543134.
- ↑ Zadeh A., Foster G. Transgenic resistance to tobacco ringspot virus (неопр.) // Acta Virol. — 2004. — Т. 48, № 3. — С. 145—152. — PMID 15595207.
- ↑ Niggeweg R., Michael A., Martin C. Engineering plants with increased levels of the antioxidant chlorogenic acid (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2004. — Vol. 22, no. 6. — P. 746—754. — doi:10.1038/nbt966. — PMID 15107863.
- ↑ Sanders R., Hiatt W. Tomato transgene structure and silencing (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2005. — Vol. 23, no. 3. — P. 287—289. — doi:10.1038/nbt0305-287b. — PMID 15765076.
- ↑ Chiang C., Wang J., Jan F., Yeh S., Gonsalves D. Comparative reactions of recombinant papaya ringspot viruses with chimeric coat protein (CP) genes and wild-type viruses on CP-transgenic papaya (англ.) // Journal of General Virology[англ.] : journal. — Microbiology Society[англ.], 2001. — Vol. 82, no. Pt 11. — P. 2827—2836. — PMID 11602796.
- ↑ Abdurakhmonov IY, Buriev ZT, Saha S, Jenkins JN, Abdukarimov A, Pepper AE. 2014. Cotton PHYA1 RNAi enhances major fiber quality and agronomic traits of cotton (Gossypium hirsutum L). Nature Communications 4:3062; DOI:10. 1038/ncomms4062
Литература
- Черноловская Е. Л. РНК-интерференция. Клин клином… // НАУКА из первых рук. — 2008. — Т. 1, № 19. — С. 54—59.
- РНК-интерференция и антисмысловой подход: конкуренты или сотоварищи? // НАУКА из первых рук. — 2008. — Т. 1, № 19. — С. 66—69.
- Кудряшова Н.Ю., Кудряшов Ю.Б. РНК-интерференция: к разгадке экспрессии генов // Биология в школе. — 2007. — № 2. — С. 7—11.
- Марахонов А. В., Баранова А. В., Скоблов М. Ю. РНК-интерференция: фундаментальные и прикладные аспекты // Медицинская генетика. — 2008. — Т. 7, № 10. — С. 44—56.
- Хаитов Р. М., Акимов В. С. Интерференция РНК // Успехи современной биологии. — Наука, 2006. — Т. 126, № 3. — С. 242—249.
- РНК-интерференция: заставить гены молчать. Вечная молодость. Дата обращения: 21 марта 2010. Архивировано 25 августа 2011 года.
- Сергей Авилов. РНК-интерференция против «неправильных» генов. Клеточная биология. Вокруг Света. Дата обращения: 21 марта 2010.
- Скоблов М. Ю. Перспективы технологий антисмысловой терапии // Молекулярная биология. — 2009. — Т. 43, вып. 6. — С. 984—998.
- Takashi Tsujiuchi, Andrew D. Miller, Toshihiko Wakabayashi, Atsushi Natsume (2014) RNA Interference Therapeutics for Tumor Therapy: Promising Work in Progress. In: Gene Therapy of Cancer (Third Edition), 2014, Chapter 27, Pages 393-408 Elsevier
- Advanced Delivery and Therapeutic Applications of RNAi. Ed. by Kun Cheng, Ram I. Mahato (2013) ISBN 978-1-118-61073-2
Ссылки
- Обзор РНК-интерференции от Cambridge University’s The Naked Scientists
- Анимация процесса РНК-интерференции из Nature
- Анимация процесса РНК-интерференции с русскими субтитрами и пояснениями
- NOVA scienceNOW о процессе RNAi, 15 минутное видео
- Silencing Genomes — эксперименты по РНК-интерференции в C. elegans. Центр изучения ДНК Cold Spring Harbor.
- Протокол использования РНК-интерференции в C. elegans в 96-луночном формате для изучения генетических взаимодействий
- Молекулярная терапия: Развитие РНК-интерференции в терапии, коллекция статей в открытом доступе из журнала Nature