Реагент Петасиса
Реагент Петасиса | |
|---|---|
 | |
Общие | |
| Систематическое наименование | диметилтитаноцен |
| Хим. формула | C₁₂H₁₆Ti |
Физические свойства | |
| Состояние | оранжевые кристаллы |
| Молярная масса | 208,13 г/моль |
Термические свойства | |
| Т. плав. | >90 ℃ |
Классификация | |
| Номер CAS | 1271-66-5 |
| ChemSpider | 34981143 |
| Номер EINECS | 679-889-8 |
C[Ti+2]C.[CH-]1C=CC=C1.[CH-]1C=CC=C1 | |
InChI | |
InChI=1S/2C5H5.2CH3.Ti/c2*1-2-4-5-3-1;;;/h2*1-5H;2*1H3;/q2*-1;;;+2 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Реаге́нт Пе́тасиса (химическая формула — (C5H5)2Ti(CH3)2) — это металлоорганическое соединение, используемое в органическом синтезе для метиленирования карбонильных соединений, то есть превращения соединений типа R2C=O в терминальные алкены вида R2C=CH2.
Получение
Реагент Петасиса получают по реакции метиллития с титаноцендихлоридом. Для этого 2,1 эквивалента литийорганического реагента добавляют к суспензии титаноцендихлорида в диэтиловом эфире при охлаждении, выдерживают в течение часа и добавляют воду. Органический слой сушат, фильтруют и упаривают, получая оранжевые кристаллы целевого комплекса с выходом 95 %. Обычно сразу после получения кристаллы растворяют в тетрагидрофуране или толуоле и хранят раствор в тёмном и холодном месте[1].

Проверить качество реагента можно при помощи ЯМР-спектроскопии: в протонном спектре в бензоле-d6 проявляются два синглета при 5,69 и 0,04 м. д. интенсивностью 10 и 6 протонов соответственно[1].
Физические свойства
Реагент Петасиса растворим в большинстве апротонных органических растворителей, например, в диэтиловом эфире, тетрагидрофуране, хлористом метилене, толуоле, петролейном эфире[1].
Применение в органическом синтезе
Реагент Петасиса применяется в синтезе для метиленирования карбонильных соединений. При этом он является источником реакционноспособного метилидентитаноцена (C5H5)2Ti=CH2, образование которого начинается при нагревании в толуоле или тетрагидрофуране до 60—75 °С[2].
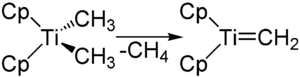
Реагент Петасиса имеет некоторые преимущества, по сравнению с аналогичным реагентом Виттига Ph3P=CH2. Реагенты Виттига проявляют основные свойства и часто не взаимодействуют правильно с субстратами, которые легко енолизуются или которые могут подвергаться нуклеофильному присоединению или элиминированию в мягких условиях. Также существуют сложности со стерически затруднёнными субстратами, а сложные эфиры и лактоны обычно вообще невозможно метиленировать по реакции Виттига[1].
Избежать этих недостатков призваны металлоорганические комплексы на основе титана. Широко используемый реагент Теббе позволяет легко метиленировать подобные «сложные» соединения, однако сам он не очень удобен в обращении из-за пирофорности и не подходит для субстратов, очень чувствительных к кислотам. Реагент Петасиса представляет собой удобную альтернативу реагенту Теббе. Его легко получать и хранить. Он позволяет метиленировать альдегиды, кетоны, эфиры и лактоны, включая субстраты, чувствительные к кислоте, и енолизируемые субстраты. Также более удобной является и обработка: методика не требует экстракций, побочный продукт (титаноксид) можно отфильтровать, а алкен очистить хроматографией или перегонкой. Выход метиленирования альдегидов может быть умеренным, однако для алкил- и арилкетонов, а также циклических кетонов реагент подходит очень хорошо[1].
Реагент Петасиса позволяет переносить к карбонильному соединению не только метиленовую группу. Из титаноцендихлорида и подходящего литий- или магнийорганического реагента получены гомологи реагента Петасиса для синтеза нетерминальных алкенов[1].
Примечания
- ↑ 1 2 3 4 5 6 Petasis N. A., Morshed M. M., Ahmad M. S., Hossain M. M., Trippier P. C. Bis(cyclopentadienyl)dimethyltitanium (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — Wiley, 2012. — doi:10.1002/047084289X.rb126.pub3.
- ↑ Vaxelaire C. Petasis Reagent (англ.) // Synlett. — 2009. — No. 19. — P. 3221—3222. — doi:10.1055/s-0029-1218382. Архивировано 4 января 2015 года.