Ретроградная холангиопанкреатография
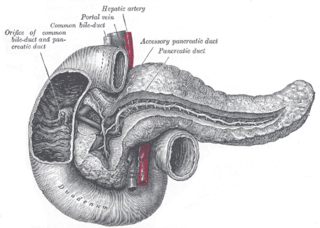
Ретроградная холангиопанкреатография (РХПГ) (англ. Endoscopic retrograde cholangiopancreatography (ERCP)) — метод, комбинирующий эндоскопию с одновременным рентгеноскопическим обследованием. Эндоскоп вводится в двенадцатиперстную кишку к большому дуоденальному сосочку, устье которого открывается в просвет двенадцатиперстной кишки. Через канал эндоскопа протягивается зонд с внутренним каналом для подачи контрастного вещества на конце которого расположена (сделанная из более плотного пластика) канюля, которую врач проталкивает в устье сосочка в жёлчные и панкреатический протоки вводится рентгеноконтрастное вещество. Затем с помощью рентгеновской аппаратуры получается изображение протоков. Метод был впервые использован в 1968 году.
Проведение обследования. Эндоскопическая «ретроградная холангиопанкреатография» (РХПГ, ЭРХПГ) выполняется только в условиях стационара. Перед исследованием всегда делается успокоительный укол. После местной анестезии глотки специальный оптический прибор (дуоденофиброскоп) проводится через рот, пищевод и желудок в двенадцатиперстную кишку к тому месту, где общий жёлчный проток и проток поджелудочной железы, соединяясь между собой, образуют ампулу большого дуоденального сосочка, устье которого открывается в просвет двенадцатиперстной кишки. С помощью специальной трубки, проведённой по каналу эндоскопа через устье сосочка в жёлчные протоки и в проток поджелудочной железы вводится рентгеноконтрастное вещество. Затем с помощью рентгеновской аппаратуры получается изображение протоковой системы. При обнаружении сужения протока или камней в нём проводится эндоскопическая операция, которая направлена на устранение препятствия и нормальной проходимости жёлчных протоков. С этой целью с помощью различных специальных инструментов, проведённых через канал эндоскопа, проводится разрез (с помощью электрического тока высокой частоты) выходной части протока, через который извлекаются камни [1], [2].
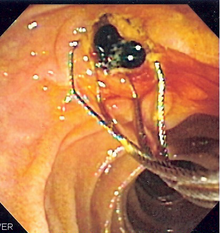

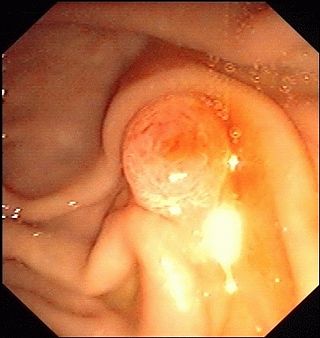
РХПГ выполняют при подозрении на холедохолитиаз, для выяснения характера механической желтухи и для изучения анатомии протоков перед операцией. Показания к РХПГ должны быть строго аргументированы, так как это инвазивная процедура.
При обнаружении закупорки или сужения протоков возможно проведение дополнительных процедур [3]:
- Введение катетера с целью удаления избыточного количества жёлчи.
- Удаление жёлчных камней, которые могут формироваться в жёлчном пузыре или жёлчных протоках.
- Сфинктеротомия: небольшой разрез в области наружного отверстия общего жёлчного протока, что обеспечивает нормальный отток жёлчи и выход небольших жёлчных камней.
- Постановка в просвет жёлчного протока стента: небольшой пластиковой или металлической трубочки, что восстанавливает проходимость протока или формирует обходные пути для нормального оттока жёлчи.
Осложнения РХПГ
Панкреатит
Это наиболее часто встречающееся осложнение РХПГ — 1,3 % −1,8 % [8, 9] и до 5,4 % [3] в группе эндоскопической ПСТ. В руководстве по осложнениям РХПГ представленным Американской Ассоциацией эндоскопии пищеварительного тракта панкреатиту, развившемуся в результате РХПГ, даётся следующее определение «появление или усиление боли в животе и повышение амилазы сыворотки в 3 или более раза выше нормы в течение 24 после выполнения РХПГ и требующие, по крайней мере, 2-дневной госпитализации». Проспективное мультицентровое исследование, выполненное Freeman et al., [4] показало, что независимыми факторами риска развития данного осложнения являются: панкреатит после РХПГ в анамнезе, баллонная дилатация сфинктера Одди, сложная и длительная канюляция, панкреатическая сфинктеротомия, более чем однократное введение контраста в панкреатический проток, подозрение на дисфункцию сфинктера Одди, женский пол, нормальный уровень билирубина и отсутствие хронического панкреатита. Два других опубликованных исследования предлагают более короткий перечень факторов риска панкреатита: возраст моложе 60 лет, предварительная сфинктеротомия и оставленные камни жёлчных протоков [9] и возраст моложе 70 лет, отсутствие дилатации жёлчевыводящих путей и введение контраста в панкреатический проток [8]. Siegel, в свою очередь, сообщает, что предварительная сфинктеротомия наоборот связана с меньшим риском развития панкреатита, чем стандартная методика ПСТ [11]. По нашим данным (чьим???), факторами риска панкреатита являются женский пол, молодой возраст, многократная канюляция (с или без введения контраста) панкреатического протока и отсутствие дилатации жёлчевыводящих путей. Что касается предварительной ПСТ, то мы (кто???) стараемся не выполнять её у лиц с вышеперечисленными факторами риска и отсутствием жёлчной гипертензии.
Меры профилактики. Предложено несколько методик, направленных на снижение числа случаев развития панкреатита после РХПГ. Технические советы: избегать повторных канюляций панкреатического протока с или без введения контраста, использовать смешанный ток с преобладанием резки при выполнении ПСТ, при проведении предварительной ПСТ проводить рассечение «через крышу», а не от устья БДС, применять фармакотерапию. Недавно опубликованное исследование, посвящённое применению соматостатина при выполнении РХПГ, продемонстрировало его эффективность в снижении вероятности развития панкреатита [2]. В этой работе соматостатин использовался либо в виде непрерывной 12-часовой инфузии (3 мг соматостатина на 500 мл физиологического раствора), начинающейся за 30 минут до проведения РХПГ, либо в виде болюсной внутривенной инъекции в момент канюляции БДС (3 мг на килограмм веса). Процент развития панкреатита в обеих группах был 1,7 %, тогда как в группе плацебо он достигал 9,8 %. Опубликованное в журнале Gut работа китайских учёных, посвящённая применению соматостатина при терапевтической РХПГ, продемонстрировала снижение риска развития панкреатита при болюсном его введении (250 мг) [10]. Хотя другое многоцентровое рандомизированное исследование не показала преимущество соматостатина и gabexate (ингибитор протеолитической активности) над плацебо в профилактике панкреатита [1]. Мы в своей практике вводим соматостатин для профилактики развития панкреатита (250 мг внутривенно болюсно) только у пациентов с факторами риска его развития. Аналог соматостатина октреотид вызывает спазм сфинктера Одди и применяться не должен.
Кровотечение Клинически значимое кровотечение развивается, как правило, после терапевтических манипуляций на БДС, например папилосфинктеротомии. Общая частота данного осложнения варьирует от 1,13-0,76 % [8, 9] достигая 2 % в группе ПСТ [3]. Клинически значимым может рассматриваться кровотечение с падением гемоглобина по крайней мере на 2 мг/децилитр или приводящее к необходимости гемотрасфузии. Источником кровотечения чаще всего является ветвь гастродуоденальной артерии. Фактором риска данного осложнения является маленькие размеры устья БДС и нарушение свёртываемости крови [3, 8]. Кровотечение в начале выполнения ПСТ не должно предупреждать её завершение и экстракцию конкрементов (если необходимо), так как сокращение тканей в области разреза и отёк, возникающий при манипуляции на соске, приводят к сдавливанию сосуда и остановке кровотечения. В случае его продолжения можно обколоть источник раствором адреналина 1:1000.
Перфорация Частота встречаемости 0,57-0,58 % [8, 9] и 0,3 %- 1,0 % [3, 11] в группе ПСТ и до 4 % при проведении предварительной ПСТ [11]. Факторы риска — предварительное рассечение, интрамуральное введение контраста и состояние после резекции по Бильроту-II [8]. Классифицируется на перфорацию проводником, преампулярную перфорацию и дуоденальную (отдалённую от соска) перфорацию [6]. Первый и иногда второй вид перфорации может быть успешно пролечен путём активной аспирации в сочетании с антибиотиками широкого спектра действия, 3-й вид чаще всего поздно диагностируется и требует оперативного лечения. [4].
См. также
Источники
- Биологи и медицина. Эндоскопическая ретроградная холангиопанкреатография: общие сведения