Рецептор, активируемый пероксисомным пролифератором гамма
Рецептор, активируемый пероксисомным пролифератором гамма (англ. Peroxisome proliferator-activated receptor gamma, сокр. PPAR-γ или PPARG), также известный как глитазоновый рецептор обратной инсулинорезистентности или NR1C3 (подсемейство ядерных рецепторов 1, группа C, тип 3) представляет собой белок — ядерный рецептор, функционирующий как транскрипционный фактор, который у человека кодируется геном PPARG, локализованный на коротком плече (p-плече) 3-й хромосомы[5][6][7].
Полипептидная цепь белка включает в себя 505 аминокислот, а молекулярная масса составляет — 57620 Да[8].
Распределение в тканях
PPARG в основном присутствует в жировой ткани, толстой кишке и макрофагах. У человека и мыши обнаружены две изоформы PPARG: PPAR-γ1 (обнаружен почти во всех тканях, кроме мышц) и PPAR-γ2 (в основном обнаружен в жировой ткани и кишечнике)[9][10].
Генная экспрессия
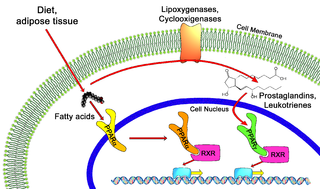
Ген PPARG кодирует белок члена подсемейства ядерных рецепторов, активируемые пероксисомным пролифератором (PPAR). PPAR образуют гетеродимеры с ретиноидными X-рецепторами (RXR), и эти гетеродимеры регулируют транскрипцию различных генов. Известны три подтипа PPAR: PPAR-альфа, PPAR-дельта и PPAR-гамма. Белок, кодируемый данным геном — PPAR-гамма, является регулятором дифференцировки адипоцитов. Описаны альтернативно сплайсированные варианты транскрипта, кодирующие различные изоформы данного белка[11].
Активность PPARG может регулироваться путём фосфорилирования через MEK/ERK-путь. Эта модификация снижает транскрипционную активность PPARG и приводит к модификации диабетических генов, а также к нечувствительности к инсулину. Например, фосфорилирование серина-112 ингибирует функцию PPARG и повышает адипогенный потенциал фибробластов[12].
Выполняемые функции
PPARG регулирует запасы жирных кислот и метаболизм глюкозы. Гены, активируемые PPARG, стимулируют поглощение липидов и адипогенез в жировых клетках. Нокаутные мыши по PPARG, лишены жировой ткани, что позволяет считать PPARG главным регулятором дифференцировки адипоцитов[13].
PPARG повышает чувствительность к инсулину, усиливая хранение жирных кислот в жировых клетках (снижая липотоксичность), усиливая высвобождение адипонектина из жировых клеток, индуцируя FGF21[13], и усиливая выработку аденин-динуклеотидфосфата никотиновой кислоты (NAADP) через регуляцию фермента CD38[14].
PPARG способствует противовоспалительной активации макрофагов M2 у мышей[15].
Адипонектин индуцирует ABCA1-опосредованный обратный транспорт холестерина путём активации PPAR-γ и LXRα/β[16].
Многие природные агенты напрямую связываются с PPAR-γ и активируют их. Эти агенты включают различные полиненасыщенные жирные кислоты, такие как арахидоновая кислота (C20) и метаболиты арахидоновой кислоты, такие как некоторые члены семейства 5-гидроксиэйкозатетраеновой кислоты и 5-оксо-эйкозатетраеновой кислоты, например, 5-оксо-15(S)-ГЭТЕ и 5-оксо-ЭТЕ или семейство 15-гидроксикозатетраеновой кислоты, включая 15(S)-ГЭТЕ, 15(R)-ГЭТЕ и 15(S)-ГПЭТЕ[17][18][19], фитоканнабиноид тетрагидроканнабинол (THC)[20], его метаболит ТГК-СООН и его синтетический аналог ажулемовая кислота (AJA)[21]. Активация PPAR-гамма этими и другими лигандами может быть ответственна за ингибирование роста культивируемых линий раковых клеток молочной железы, желудка, лёгких, предстательной железы и других раковых клеток человека[22][23].
Во время эмбриогенеза PPARG сначала в значительной степени экспрессируется в межлопаточной бурой жировой подушке[24]. Истощение PPARG приведёт к эмбриональной смертности на этапе E10.5 из-за сосудистых аномалий в плаценте без проникновения в кровеносные сосуды плода, а также расширения и разрыва материнских кровеносных синусов[25]. Экспрессия PPARG может быть обнаружена в плаценте уже на E8.5 и в течение оставшейся части беременности, в основном локализована в первичных клетках трофобласта плаценты человека[24]. PPARG необходим для эпителиальной дифференцировки ткани трофобласта, что имеет решающее значение для правильной васкуляризации плаценты. Агонисты PPARG ингибируют инвазию экстраворсинчатых цитотрофобластов. PPARG также необходим для накопления липидных капель плацентой[12].
Взаимодействия с белками
Было показано, что рецептор, активируемый пероксисомным пролифератором гамма взаимодействует с:
Исследования
Агонисты PPAR-гамма используются для лечения гиперлипидемии и гипергликемии[37][38].
Многие инсулиносенсибилизирующие препараты (в частности, тиазолидиндионы), используемые в лечении сахарного диабета, активируют PPARG как средство снижения уровня глюкозы в сыворотке крови без увеличения секреции инсулина поджелудочной железой. Активация PPARG более эффективна при инсулинорезистентности скелетных мышц, чем при инсулинорезистентности печени[39].
См. также
Примечания
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000132170 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000000440 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Greene ME, Blumberg B, McBride OW, Yi HF, Kronquist K, Kwan K, et al. (1995). "Isolation of the human peroxisome proliferator activated receptor gamma cDNA: expression in hematopoietic cells and chromosomal mapping". Gene Expression. 4 (4—5): 281—99. PMC 6134382. PMID 7787419.
- ↑ Elbrecht A, Chen Y, Cullinan CA, Hayes N, Leibowitz MD, Moller DE, Berger J (July 1996). "Molecular cloning, expression and characterization of human peroxisome proliferator activated receptors gamma 1 and gamma 2". Biochemical and Biophysical Research Communications. 224 (2): 431—7. doi:10.1006/bbrc.1996.1044. PMID 8702406.
- ↑ Michalik L, Auwerx J, Berger JP, Chatterjee VK, Glass CK, Gonzalez FJ, et al. (December 2006). "International Union of Pharmacology. LXI. Peroxisome proliferator-activated receptors". Pharmacological Reviews. 58 (4): 726—41. doi:10.1124/pr.58.4.5. PMID 17132851. S2CID 2240461.
- ↑ UniProt, P37231 (англ.).
- ↑ Fajas L, Auboeuf D, Raspé E, Schoonjans K, Lefebvre AM, Saladin R, et al. (July 1997). "The organization, promoter analysis, and expression of the human PPARgamma gene". The Journal of Biological Chemistry. 272 (30): 18779—89. doi:10.1074/jbc.272.30.18779. PMID 9228052.
- ↑ Park YK, Wang L, Giampietro A, Lai B, Lee JE, Ge K (January 2017). "Distinct Roles of Transcription Factors KLF4, Krox20, and Peroxisome Proliferator-Activated Receptor γ in Adipogenesis". Molecular and Cellular Biology. 37 (2): 18779—89. doi:10.1128/MCB.00554-16. PMC 5214852. PMID 27777310.
- ↑ Entrez Gene: PPARG peroxisome proliferator-activated receptor gamma.
- ↑ 1 2 Suwaki N, Masuyama H, Masumoto A, Takamoto N, Hiramatsu Y (April 2007). "Expression and potential role of peroxisome proliferator-activated receptor gamma in the placenta of diabetic pregnancy". Placenta. 28 (4): 315—23. doi:10.1016/j.placenta.2006.04.002. PMID 16753211.
- ↑ 1 2 Ahmadian M, Suh JM, Hah N, Liddle C, Atkins AR, Downes M, Evans RM (May 2013). "PPARγ signaling and metabolism: the good, the bad and the future". Nature Medicine. 19 (5): 557—66. doi:10.1038/nm.3159. PMC 3870016. PMID 23652116.
- ↑ Song EK, Lee YR, Kim YR, Yeom JH, Yoo CH, Kim HK, et al. (December 2012). "NAADP mediates insulin-stimulated glucose uptake and insulin sensitization by PPARγ in adipocytes". Cell Reports. 2 (6): 1607—19. doi:10.1016/j.celrep.2012.10.018. PMID 23177620.
- ↑ 1 2 Peluso I, Morabito G, Urban L, Ioannone F, Serafini M (December 2012). "Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst". Endocrine, Metabolic & Immune Disorders Drug Targets. 12 (4): 351—60. doi:10.2174/187153012803832602. PMID 23061409.
- ↑ Hafiane A, Gasbarrino K, Daskalopoulou SS (November 2019). "The role of adiponectin in cholesterol efflux and HDL biogenesis and metabolism". Metabolism. 100: 153953. doi:10.1016/j.metabol.2019.153953. PMID 31377319. S2CID 203413137.
- ↑ Dreyer C, Keller H, Mahfoudi A, Laudet V, Krey G, Wahli W (1993). "Positive regulation of the peroxisomal beta-oxidation pathway by fatty acids through activation of peroxisome proliferator-activated receptors (PPAR)". Biology of the Cell. 77 (1): 67—76. doi:10.1016/s0248-4900(05)80176-5. PMID 8390886. S2CID 10746292.
- ↑ O'Flaherty JT, Rogers LC, Paumi CM, Hantgan RR, Thomas LR, Clay CE, et al. (October 2005). "5-Oxo-ETE analogs and the proliferation of cancer cells". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1736 (3): 228—36. doi:10.1016/j.bbalip.2005.08.009. PMID 16154383.
- ↑ Naruhn S, Meissner W, Adhikary T, Kaddatz K, Klein T, Watzer B, et al. (February 2010). "15-hydroxyeicosatetraenoic acid is a preferential peroxisome proliferator-activated receptor beta/delta agonist". Molecular Pharmacology. 77 (2): 171—84. doi:10.1124/mol.109.060541. PMID 19903832. S2CID 30996954.
- ↑ O'Sullivan SE, Tarling EJ, Bennett AJ, Kendall DA, Randall MD (November 2005). "Novel time-dependent vascular actions of Delta9-tetrahydrocannabinol mediated by peroxisome proliferator-activated receptor gamma". Biochemical and Biophysical Research Communications. 337 (3): 824—31. doi:10.1016/j.bbrc.2005.09.121. PMID 16213464.
- ↑ Liu J, Li H, Burstein SH, Zurier RB, Chen JD (May 2003). "Activation and binding of peroxisome proliferator-activated receptor gamma by synthetic cannabinoid ajulemic acid". Molecular Pharmacology. 63 (5): 983—92. doi:10.1124/mol.63.5.983. PMID 12695526. S2CID 22671555.
- ↑ Krishnan A, Nair SA, Pillai MR (September 2007). "Biology of PPAR gamma in cancer: a critical review on existing lacunae". Current Molecular Medicine. 7 (6): 532—40. doi:10.2174/156652407781695765. PMID 17896990.
- ↑ Ezzeddini R, Taghikhani M, Salek Farrokhi A, Somi MH, Samadi N, Esfahani A, Rasaee, MJ (May 2021). "Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance". Journal of Physiology and Biochemistry. 77 (2): 249—260. doi:10.1007/s13105-021-00791-3. PMID 33730333. S2CID 232300877. Архивировано 6 апреля 2023. Дата обращения: 12 декабря 2023.
- ↑ 1 2 Barak Y, Nelson MC, Ong ES, Jones YZ, Ruiz-Lozano P, Chien KR, et al. (October 1999). "PPAR gamma is required for placental, cardiac, and adipose tissue development". Molecular Cell. 4 (4): 585—95. doi:10.1016/s1097-2765(00)80209-9. PMID 10549290.
- ↑ Schaiff WT, Barak Y, Sadovsky Y (April 2006). "The pleiotropic function of PPAR gamma in the placenta". Molecular and Cellular Endocrinology. 249 (1—2): 10—5. doi:10.1016/j.mce.2006.02.009. PMID 16574314. S2CID 54322301.
- ↑ Brendel C, Gelman L, Auwerx J (June 2002). "Multiprotein bridging factor-1 (MBF-1) is a cofactor for nuclear receptors that regulate lipid metabolism". Molecular Endocrinology. 16 (6): 1367—77. doi:10.1210/mend.16.6.0843. PMID 12040021.
- ↑ Berger J, Patel HV, Woods J, Hayes NS, Parent SA, Clemas J, et al. (April 2000). "A PPARgamma mutant serves as a dominant negative inhibitor of PPAR signaling and is localized in the nucleus". Molecular and Cellular Endocrinology. 162 (1—2): 57—67. doi:10.1016/S0303-7207(00)00211-2. PMID 10854698. S2CID 20343538.
- ↑ Gampe RT, Montana VG, Lambert MH, Miller AB, Bledsoe RK, Milburn MV, et al. (March 2000). "Asymmetry in the PPARgamma/RXRalpha crystal structure reveals the molecular basis of heterodimerization among nuclear receptors". Molecular Cell. 5 (3): 545—55. doi:10.1016/S1097-2765(00)80448-7. PMID 10882139.
- ↑ 1 2 3 Fajas L, Egler V, Reiter R, Hansen J, Kristiansen K, Debril MB, et al. (December 2002). "The retinoblastoma-histone deacetylase 3 complex inhibits PPARgamma and adipocyte differentiation". Developmental Cell. 3 (6): 903—10. doi:10.1016/S1534-5807(02)00360-X. PMID 12479814.
- ↑ 1 2 3 4 Kodera Y, Takeyama K, Murayama A, Suzawa M, Masuhiro Y, Kato S (October 2000). "Ligand type-specific interactions of peroxisome proliferator-activated receptor gamma with transcriptional coactivators". The Journal of Biological Chemistry. 275 (43): 33201—4. doi:10.1074/jbc.C000517200. PMID 10944516.
- ↑ Franco PJ, Li G, Wei LN (August 2003). "Interaction of nuclear receptor zinc finger DNA binding domains with histone deacetylase". Molecular and Cellular Endocrinology. 206 (1—2): 1—12. doi:10.1016/S0303-7207(03)00254-5. PMID 12943985. S2CID 19487189.
- ↑ Heinlein CA, Ting HJ, Yeh S, Chang C (June 1999). "Identification of ARA70 as a ligand-enhanced coactivator for the peroxisome proliferator-activated receptor gamma". The Journal of Biological Chemistry. 274 (23): 16147—52. doi:10.1074/jbc.274.23.16147. PMID 10347167.
- ↑ Nishizawa H, Yamagata K, Shimomura I, Takahashi M, Kuriyama H, Kishida K, et al. (January 2002). "Small heterodimer partner, an orphan nuclear receptor, augments peroxisome proliferator-activated receptor gamma transactivation". The Journal of Biological Chemistry. 277 (2): 1586—92. doi:10.1074/jbc.M104301200. PMID 11696534.
- ↑ Wallberg AE, Yamamura S, Malik S, Spiegelman BM, Roeder RG (November 2003). "Coordination of p300-mediated chromatin remodeling and TRAP/mediator function through coactivator PGC-1alpha". Molecular Cell. 12 (5): 1137—49. doi:10.1016/S1097-2765(03)00391-5. PMID 14636573.
- ↑ Puigserver P, Adelmant G, Wu Z, Fan M, Xu J, O'Malley B, Spiegelman BM (November 1999). "Activation of PPARgamma coactivator-1 through transcription factor docking". Science. 286 (5443): 1368—71. doi:10.1126/science.286.5443.1368. PMID 10558993.
- ↑ Mittal S, Inamdar S, Acharya J, Pekhale K, Kalamkar S, Boppana R, Ghaskadbi S (October 2020). "miR-3666 inhibits development of hepatic steatosis by negatively regulating PPARγ". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1865 (10): 158777. doi:10.1016/j.bbalip.2020.158777. PMID 32755726. S2CID 221017099.
- ↑ Lehrke M, Lazar MA (December 2005). "The many faces of PPARgamma". review. Cell. 123 (6): 993—9. doi:10.1016/j.cell.2005.11.026. PMID 16360030. S2CID 18526710.
- ↑ Kim JH, Song J, Park KW (March 2015). "The multifaceted factor peroxisome proliferator-activated receptor γ (PPARγ) in metabolism, immunity, and cancer". review. Archives of Pharmacal Research. 38 (3): 302—12. doi:10.1007/s12272-015-0559-x. PMID 25579849. S2CID 12296573.
- ↑ Abdul-Ghani MA, Tripathy D, DeFronzo RA (May 2006). "Contributions of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose". review. Diabetes Care. 29 (5): 1130—9. doi:10.2337/dc05-2179. PMID 16644654.